一、慢病毒(LV)载体系统组分
1. Lentiviral transfer plasmid encoding your insert of interest:简称Transfer质粒,就是携带你目的基因的质粒,也是通常我们需要做载体改造的质粒,通常长这样:
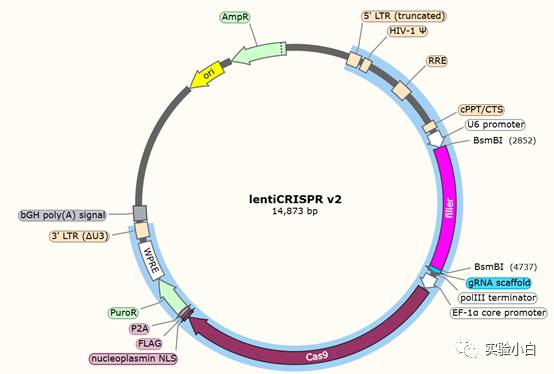
选中的部分就是LV transfer 质粒的主体,通常是位于两个LTR之间;
注:lentiCRISPRV2可以兼容第二代、三代包装系统。
2. Packaging plasmid(s):LV病毒包装的结构蛋白编码质粒,通常都会表达Gag, Pol, Rev跟Tat等基因。
3.Envelope plasmid:LV蛋白质外壳编码的质粒,比如常用有VSV-G;
通常LV包装系统分为1、2、3代,现在常用的是2代和3代。一般情况是代数越靠后越安全,但目前最流行的是第二代系统。
First generation:LV packaging system encompasses all HIV-1 genes except the envelope。不安全,没人用了。
Second generation:will fit most of the experiments. LV packaging system is additionally deleted for all viral auxilliary genes, i.e. vpr, vif, vpu and nef (example: pCMV-dR8.91, pCMV-dR8.74, psPAX2),最适用,最流行。该系统的transfer质粒中利用的LTR是病毒本身的,没有加以改造。因此启动子活性偏弱,需要Tat蛋白辅助表达。
Third generation:LV packaging system comprises only gag, coding for the virion main sturctural proteins and pol, coding for the retrovirus-specific enymes. A cDNA encoding rev, which encodes a post-tranional regulator necessary for efficient gag and pol expression, is provided on a separate plasmid. The third generation packaging system offers maximal biosafety but is more cumbersome, involving the transfection of four different plasmids in the producer cells. (example : pMDL g/p RRE + pRSV-Rev + pMD2G + pLV vector),更安全,但滴度不如2代高,部分实验室在用。一般不推荐。该系统中transfer质粒中5’LTR是跟其他启动子融合的,活性较强,可以不依赖于Tat。
注:以上英文内容来自http://tronolab.epfl.ch/lentivectors。注释为笔者添加。
Addgene上也列出了常见的第二代和第三代包装系统,如下(https://www.addgene.org/viral-vectors/lentivirus/lenti-guide/):
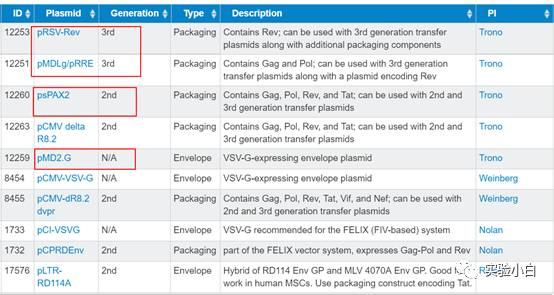
通常,第二代的包装系统能够兼容第三代的transfer 质粒,反之则不可以。
本文主要讲述最常见的第二代包装系统– psPAX2和pMD2.G。
二、LV的包装
LV包装大体流程如下:
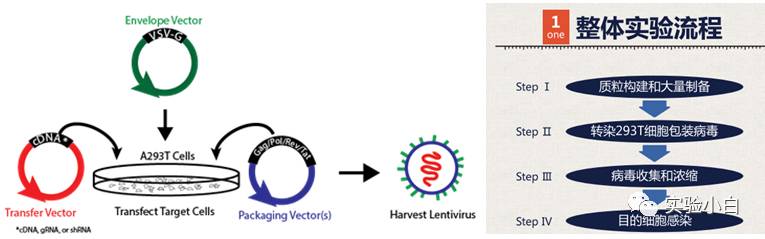
图1 LV包装流程,其中左图来自网络,右图来自汉恒慢病毒产品手册。
简而言之就是把transfer质粒跟包装系统质粒(2个或3个)按照一定的比例共转到HEK-293T中,合适的时间点收取病毒上清即可。
Day 0:Set up 293T cells. 密度控制在转染的时候达到80%即可。太稀导致滴度上不去,太高后期细胞会死亡,导致滴度下降;细胞状态务必要足够好,传代时间在一个月之内。
Day1:对于100 mm dish按照如下比例配制转染细胞(其他dish按照底面积自行换算):

注:质粒需要高质量制备,推荐MN的中抽或者大抽kit。不去内毒素、或者国产公司的质量较差的中抽kit会极大影响病毒滴度。
按照转染试剂说明书(比如lipo2000等)转染细胞。
Day3:48hr收集第一次的额病毒上清,4度留存。
Day4:72hr收集第二次的额病毒上清,4度留存。
然后两批混合起来,3000g离心10min去除细胞碎片,0.45 mM滤器除菌分装保存在-80待用。
三、LV滴度测定
(一般实验不需要测滴度,直接感染目的细胞建系即可,比如六孔板每孔加入病毒2ml)。目的细胞铺到96-well plate/或者24-well plate,保证24hr后细胞覆盖20-40%之间。从1到8排依次5倍梯度稀释病毒后感染目的细胞(图2)(感染时间12hr)。
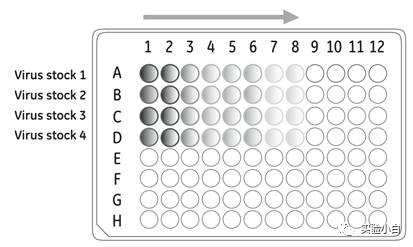
图2 滴度测定示意图(图片来自GE产品说明书)
48hr后通过XFP(如果有)荧光克隆阳性的细胞数计算病毒滴度(图3)。
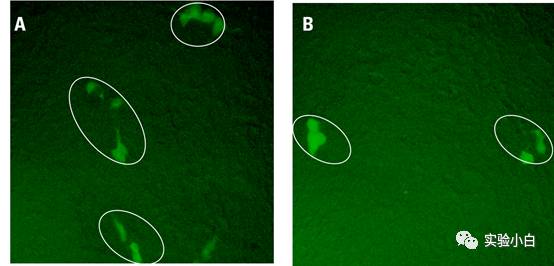
图3 显微镜下表达绿色荧光蛋白的克隆(图片来自GE产品说明书)
如果只带有Puromycin等抗性基因,则需要用对应的药物筛选,然后通过克隆个数来计算病毒滴度(图4)。
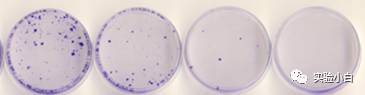
图4 抗生素筛选得到的克隆