流式细胞术是一种非常成熟的技术,在临床前和临床过程中有广泛的应用并发挥了非常重要的作用。使用流式细胞术的受体占有率(RO)分析是一种稳健的分析方法,旨在识别、量化和监测治疗药物与其靶点的结合。众所周知,在药物临床研究中,RO分析可辅助剂量设定、帮助评估生物治剂的最小生物效应水平、最佳剂量并建立合理给药方案。RO分析可用于安全性评估,评估长期饱和RO导致的毒副作用的可能性。RO通常被视为药效学(PD)生物标记物数据,并与传统的药代动力学(PK)评估相结合,用于建模PK/PD关系,是基于机制的药物对细胞表面靶点PK/PD建模的基石。
1.RO检测模式和检测原理
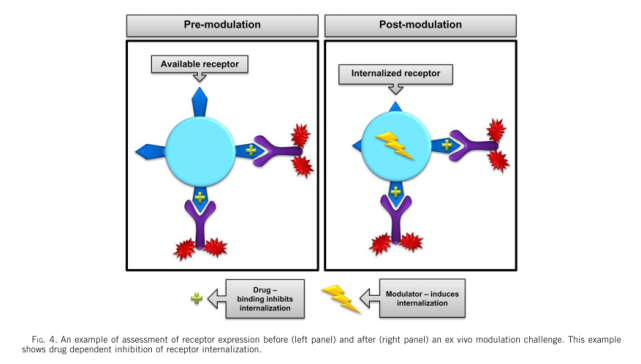
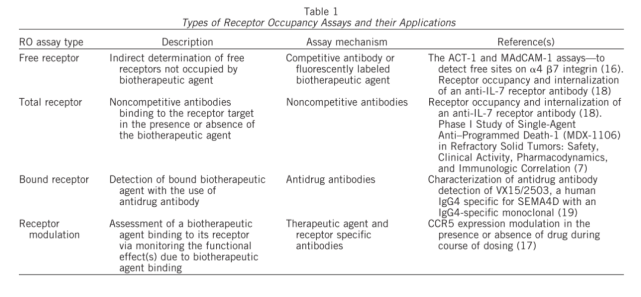
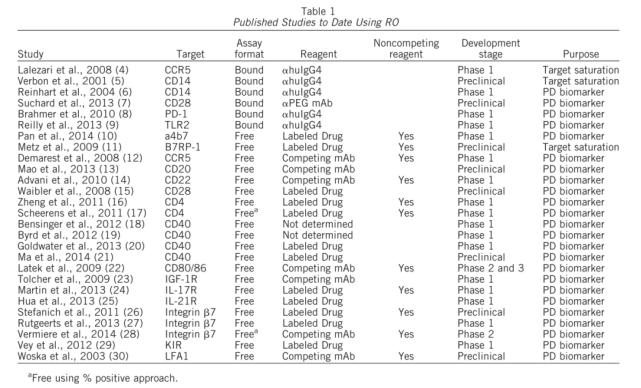
通常用于RO评估的分析有两种基本类型(如图1所示)。利用与药物分子竞争的荧光标记抗体(通常是药物分子的荧光标记版本)评估未占用或未结合(称为“自由的”)位点比例的间接方法。此分析将报告在给药后自由可用受体的水平。第二种方法是直接评估结合药物的水平。在该试验中,使用荧光标记的识别药物分子的抗体(称为“结合的”)。这两种检测方法都可以用来评估阳性细胞相对于背景对照(例如荧光减一对照、同型对照)的比例,或者测量受体表达的平均荧光强度(MFI)或中值荧光强度(MdFI)。“自由”和“结合”分析模式及其许多变体模式已经广泛用于临床前和临床开发和上市后研究,这说明了这些分析在药物开发过程中的重要性和实用性。因为在给药的过程中,受体的表达水平可能发生变化,对于一个严谨的检测,则需要同时监测给药过程中总受体水平的变化。对于某些药物,如果其作用机制是调节细胞表面受体的水平(如图2所示),则总受体水平的检测是必须的。因此,总受体的检测在很多应用中也是需要的。表1汇总的RO检测的类型与可能的应用。
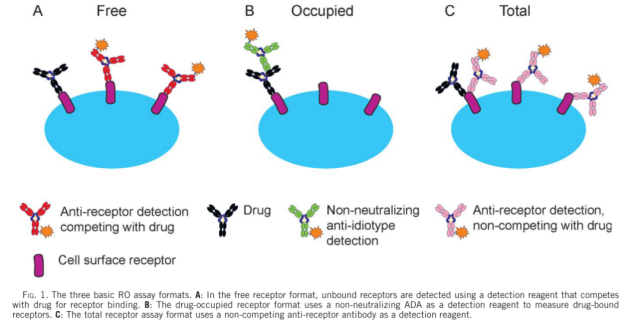
2. RO实验设计时需要考量的因素
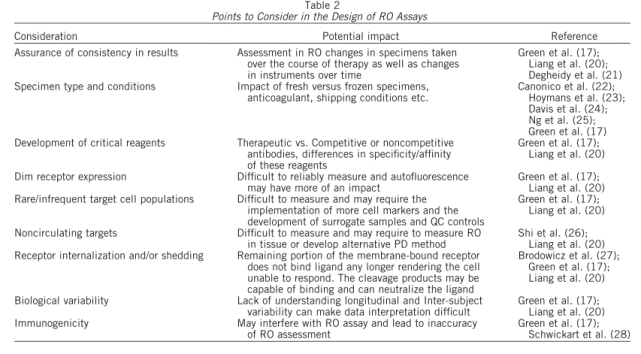
如表2中列出了很多在实验设计时需要考量的因素,如测试样本的种类和条件,关键试剂的制备,受体表达的水平和靶细胞的丰度,靶点在给药过程中表达水平的变化等等。在实践中,检测的靶点是确定的,则靶细胞的亚群,靶点表达丰度等都是确定的,也很难改变。但是其中有两点是非常值得关注,并可能基于项目进行调整和变化的。
其一,为测试样本的类型。对于受体占位研究,应用最多的是全血,因为其采集样品相对方便。临床前动物实验是分批操作,检测分析实验室一般与动物设施相邻比较近,检测方便,因而使用全血分析的情况更多。然而,在临床实践中,因为临床研究中心一般离分析实验室很远,甚至分布在全国各地,全血样本对分析的时效性提出了很高的要求,同时,对运输时效的要求也提高,运输成本相应的也很高。因为每个分析批分析的样本数量较少,造成单个样本的分析成本很高,同时也造成的实验资源的浪费。对于多数靶点,因为分离的PBMC,在-80℃或者液氮中能够保存较长的时间,对靶点占位率影响很小,因而越来越受到欢迎。精翰生物流式项目团队,通过多个项目的经验积累,已经与多家临床研究中心(医院)合作,提供全血分离PBMC的整套解决方案,包括样品采集,PBMC分离试剂、耗材以及操作培训,PBMC冻存试剂、耗材以及操作培训,PBMC运输及注意事项等一整套解决方案。所以在绝大数情况下,选用分离的PBMC进行方法开发、验证以及样品分析,相比全血检测是较好的选择。
其二,为检测模式的选择。如上文所述,检测模式主要分为“自由”和”结合”模式。如表3,列出了自2001年至2014年公开发表的RO检测的文献。通过检测模式一栏,大家可以发现使用“自由”模式相对较多。笔者认为主要有以下几点原因。
(1)检测试剂容易获得,对于“自由”检测模式,一般使用荧光素标记的药物,或者生物素标记的药物,配合荧光素标记的链霉亲和素使用。荧光素标记或者生物素标记抗体或者蛋白是实验室的常规操作,仅需要很少的资源即可获得。而对于”结合”模式来讲,一般需要使用荧光素标记或者生物素标记的针对药物的特异性抗体,而该抗体的获得需要较长时间,对于多克隆抗体,获得的量是有限的,还需要用于ADA,Nab等实验中,而对于单克隆抗体,其获得的时间周期和成本则更高。
(2)对于“自由”检测模式,获得的实验信噪比更高,实验误差更小。一般来说,抗体药物针对靶点的亲和力都很高,一般其亲和力常数会在1010M-1以上,因而抗体与靶点之间的结合比较牢固。而对于”结合”模式来讲,如果使用抗药多克隆抗体,多数抗体的亲和力多数在109M-1以下,如果使用抗药单克隆抗体,抗体的亲和力多数在109-1010M-1左右,因而,检测抗体与药物之间的结合相对较弱,进而影响实验检测获得的信噪比。笔者在多个项目中,都遇到了类似的情况。
那是不是”自由”模式比“结合”模式更好呢,笔者却不认同,主要基于以下两点考虑。
第一,“结合”模式的扩展性更好。如果需要考察给药过程中总受体水平的变化,对于“结合”模式因为其可以通过在体外加入过量药物使受体全部结合上药物的方式,从而达到检测总受体的目的。因为只需要开发和验证一种检测方法,因而具备较高的成本优势。
而如图1所示的总受体检测模式,即找到一种与药物结合同一靶点,又与药物互不干扰的检测抗体。实际工作中,找到一个此类型的检测抗体其实是需要花费很多的时间和财力的。而且,方法开发和验证同样需要花费一定的时间和财力。当然,如果后期检测的样本量很大,那么如图3所示的,在一个检测管中同时检测”结合”受体和总受体的方案,应该更具有成本优势,此时寻找或者开发与药物非竞争的检测抗体,时间和财力的付出都是值得的。当然,方法开发和验证工作会相对复杂一些。
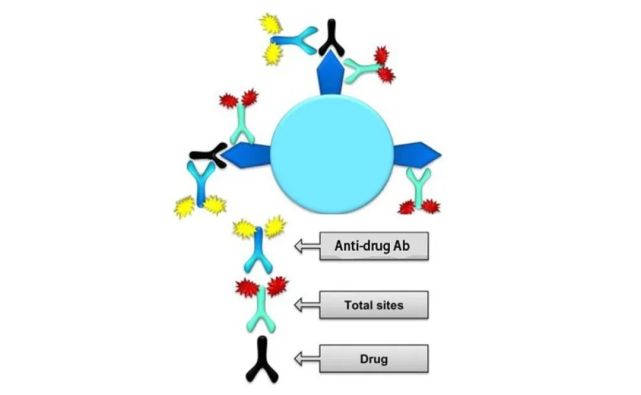
第二,“自由模式”容易受到ADA和Nab的影响,尤其是使用全血进行RO检测时。如下图4A所示,由于有Nab的产生,加入的检测试剂被Nab识别中和,不能结合到靶点上,最后造成过高的估计的药物的RO水平。而图4B所指的是另外一种情况,由于存在ADA,ADA与药物结合,进而ADA的另外一端可以和标记的药物结合,或者ADA两端都可以和标记的药物结合,造成信号放大,造成过低的估计药物的RO水平,进而影响实验结果的准确性。
3. RO方法学开发与优化
在方法开发阶段,如果有相关的试剂,建议可以多尝试几种不同的检测模式。同一种的检测模式,同样可以使用不同的检测试剂。建议在方法开发的最早期,可以进行简单的测试,评估不同方法,不同检测试剂可以获得的实验参数,比如信噪比,比如变异系数。然后选择1-2种检测模式或者检测试剂,进行后期的方法优化。方法优化常涉及到试剂浓度的优化,反应体系的优化,反应温度的优化,各种缓冲液的优化与调整,荧光染料的调整,目标亚群,设门策略的调整等内容。
4. RO方法学验证
因为至今为止,并没有任何官方的指南或者要求适用于基于流式细胞术的RO分析。通常,流式细胞术基于分析的验证程序是针对应用目的的验证(fit forpurpose)。目的主要是评估分析性能适用于研究的条件。当然,也有一系列相对有章可循的参数验证适用于RO实验的验证工作。如批内和批间分析批的精密度验证,处理前样本稳定性验证,处理后样本稳定性的验证,实验稳健性的验证等验证工作。在过往的工作中,熙宁/精翰流式团队积累了大量关于肿瘤免疫类靶点,如PD-1,PD-L1,LAG-3,VISTA,BTLA,Tim3,TIGIT,OX40,CD3,CD137,CD40,GITR等靶点的方法开发和验证(可行性研究)经验。期待与更多的企业开展相关的合作。
5. 结语
RO是评估药物开发过程中PK/PD与细胞表面靶点关系的一种有效的工具,可作为PD反应的替代评估方案。RO用于PD反应测量的实用性在于,它易于使用外周血样本进行分析,并且与血浆药物浓度有直接关系。尽管RO并不代表真正的药理学反应,但它作为预期的效应替代物,是在基于机制的PK/PD建模中确定PD并促进剂量设定决策的重要工具。
到目前为止,RO测量主要用于指导剂量选择。随着检测精度和样品稳定性的提高,疾病组织中(例如肿瘤活检)受体定量检测可能成为IHC的替代方法,扩大RO在药物开发中的应用。
参考文献
『1』.Green,C.L., et al., Recommendations for the development and validation of flow cytometry-based receptor occupancy assays. Cytometry B Clin Cytom, 2016. 90(2): p. 141-9.
『2』.Liang,M., et al., Receptor occupancy assessment by flow cytometry as a pharmacodynamic biomarker in biopharmaceutical development. Cytometry B Clin Cytom, 2016. 90(2): p. 117-27.
『3』. Sternebring,O., et al., A weighted method for estimation of receptor occupancy for pharmacodynamic measurements in drug development. Cytometry B Clin Cytom, 2016. 90(2): p. 220-9.
『4』.Stewart,J.J., et al., Role of receptor occupancy assays by flow cytometry indrug development. Cytometry B Clin Cytom, 2016. 90(2): p. 110-6.
你好,我可以问一下受体占有率测定中PE-anti-human-IgG Fc 段结合的是药物还是细胞上的受体。
你好,不清楚您用的是哪种方式检测RO,看您的意思应该是用的PE-anti-human-IgG的二抗,那你检测的是抗体类药物吧,这个二抗就是和抗体药结合。
可以继续一起讨论,最近我也在做一个小分子药物的RO
您好,请问做OX40受体占位检测是测CD4+还是测Treg 比较好?另外我们怎么确定二抗是有效的呢?谢谢
您好,OX40没有做过,不过作为T细胞活化marker,多种T细胞中均有OX40,我觉得做RO的话最好考虑所有的,也就是直接从CD3 T细胞去看,用一个与TA非竞争性抗体检测total,竞争性抗体检测游离位点,如果focus的就是某一类T细胞亚群,那你就圈出之后分析RO
二抗指的是?
您好,想了解一下多肽药物的RO分析,具体实验protocol能分享吗