流式细胞术验证-稳定性
多参数流式细胞术可以同时表征多个细胞亚群。如果有合适的试剂,流式细胞仪可用于确定细胞发育表型和功能状态,包括其激活状态、发育阶段、细胞周期状态和信号转导途径等。
流式细胞仪可用于药物开发的所有阶段。既可以用于临床前的研究,也可以用于临床分析中。例如,可以用于PK分析,如细胞治疗产品CART药物。也可以进行PD 分析,如抗体类药物的受体占位分析;免疫调节类药物的引起细胞亚群的变化,如T、B、NK、Treg等细胞占比和绝对数量的分析;抗体类药物甚至是小分子药物引起的信号通路内磷酸化蛋白的变化;以及对于部分血液瘤治疗后患者体内微小残留病MRD的监测。流式的检测,也可以作为患者入组,以及患者分级管理的依据。
一般情况下,在晚期临床研究中,一般包含多个临床研究中心,所有的样品需要寄送到同一个分析实验室。样品在同一个实验室进行分析的优势在于,可以最大限度的降低因样品处理,实验操作,仪器设置以及数据分析造成的差异。而其中最大的挑战在于样品采集后需要经过运输后才能进行样品处理和分析,因此,评估样品处理前的稳定性是非常必要的。同样,样品染色后,可能由于仪器正在采集其他项目的样品,或者仪器可能出现的短期故障而不能马上进行样品分析,需要评估样品染色后是稳定性。
进行稳定性的评估和验证时,一般需要考量如下因素:
(1)样品采集管的类型,主要包括EDTA抗凝管,肝素钠抗凝管,Cyto-chex管,Trans-Fix管,博真科技细胞保存液和保存管等。
(2)样品的运输温度,对于外周血,一般有2-8℃和室温两种选择。
(3)样品可以运输和储存的时间,基于临床中心与检测实验室之前的距离,目前,国内主要城市间可以实现24-48小时内运抵实验室。
(4)样品处理和实验的流程,基于流式检测的需要,一般分为全血直接染色或者裂红后富集白细胞两种主要的操作。
(5)样品染色后储存的温度和时间,基于实验室的需要,一般会验证2-4小时,24小时,48小时,72小时等时间点。
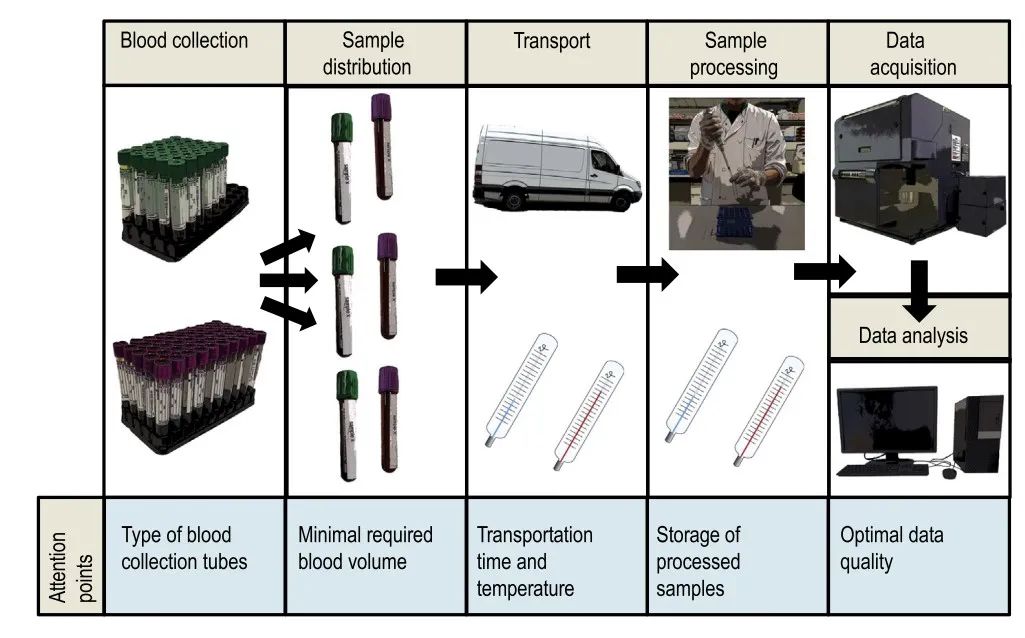
图1. 临床试验中稳定性中需要考量的因素
下面,我们将结合一篇文献,考察一下各主要因素的影响。
本参考文献的主要操作依据EuroFlow Bulk Lysis的相关SOP进行。染色方案为EuroFlow推荐的PIDTO方案。

图2. PIDTO染色方案
在本文献中,作者分享了使用EDTA和肝素钠抗凝剂采集的外周血,染色后放置在4℃不同的时间,0小时,24小时,30小时,48小时的染色后样品的稳定性。同时,也测试了使用肝素钠采集外周血分别在4℃和室温的条件下保存24小时,30小时和48小时的数据。
结果表明,用EDTA和肝素钠采血管收集的外周血,经过抗体孵育之后,延迟上机,两种抗凝剂得到检测结果是相似的:4℃保存48h内上机检测样本的表面抗原,结果都表现的比较可靠。对肝素钠采血管内的外周血在抗体孵育前分别进行室温和4℃保存48h,在不同时间点对表面抗原进行检测,结果表明室温保存的样本表面抗原表达的稳定性要优于4℃保存的条件。另外,值得注意的是,如图E所示,使用EDTA和肝素钠两种抗凝剂,分别保存在4℃和室温,使用两种方法Sysmex和Perfect count进行绝对计数。使用Perfect count方法,绝对计数值随着保存的时间逐渐降低,而Sysmex方法,除了肝素钠抗凝剂在4℃条件下,相差较多外,其它三种条件差异不大。更多结果请参考原文献。
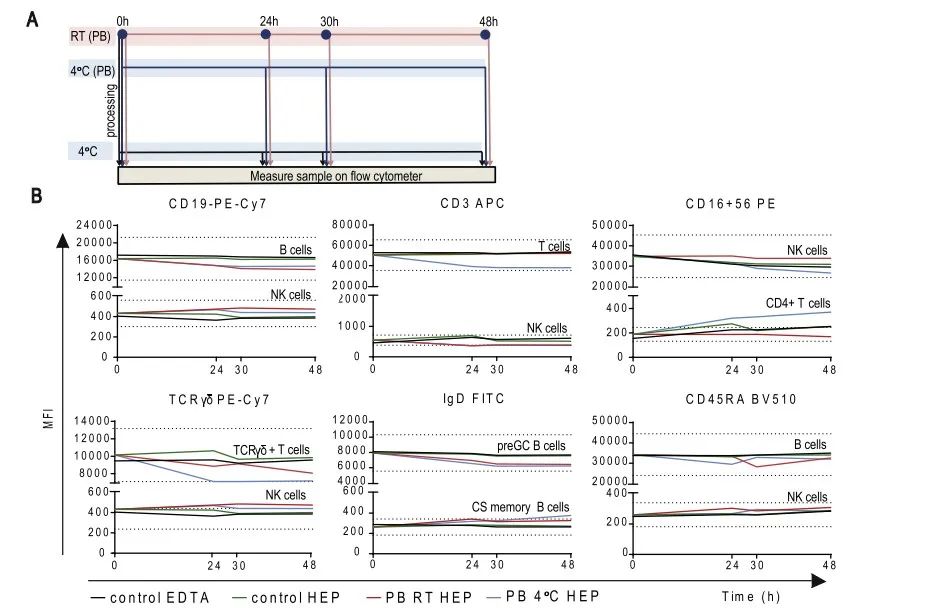
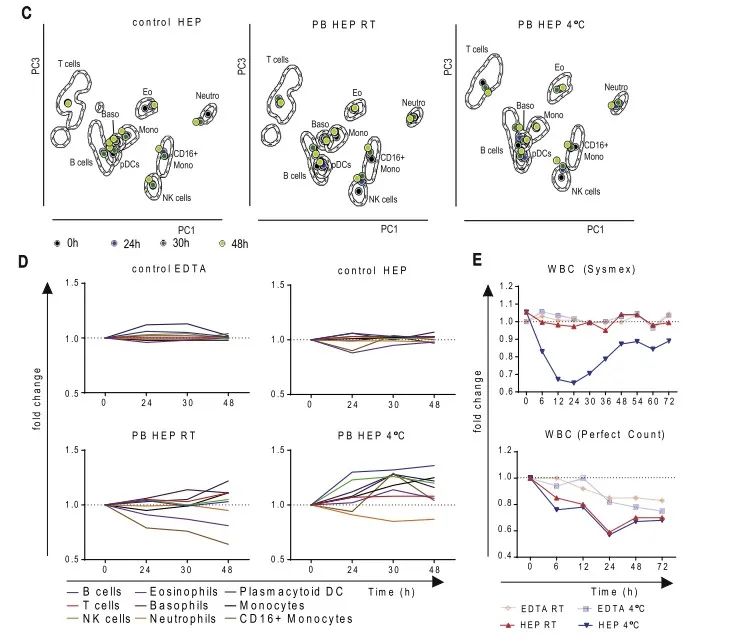
图3. 采血管对流式结果的影响
如图A所示,测试了两种管子,Cyto-chex和Trans-Fix,三种条件,Cyto-chex RT,Trans-Fix RT和Trans-Fix 4℃。主要结果如下:Cyto-Chex和Trans-Fix都影响对多个细胞群的位置有些影响。用Trans-Fix处理的样品,中性粒细胞数量的减少尤为突出。其它的细胞亚群, 随着时间的流逝,细胞群体保持相对稳定。总体而言,Cyto-chex和Trans-Fix可以显著延长某些细胞亚群的稳定性,样品在室温下保存的样品的性能略好于在4°C下保存的样品。更多结果请参考原文献。
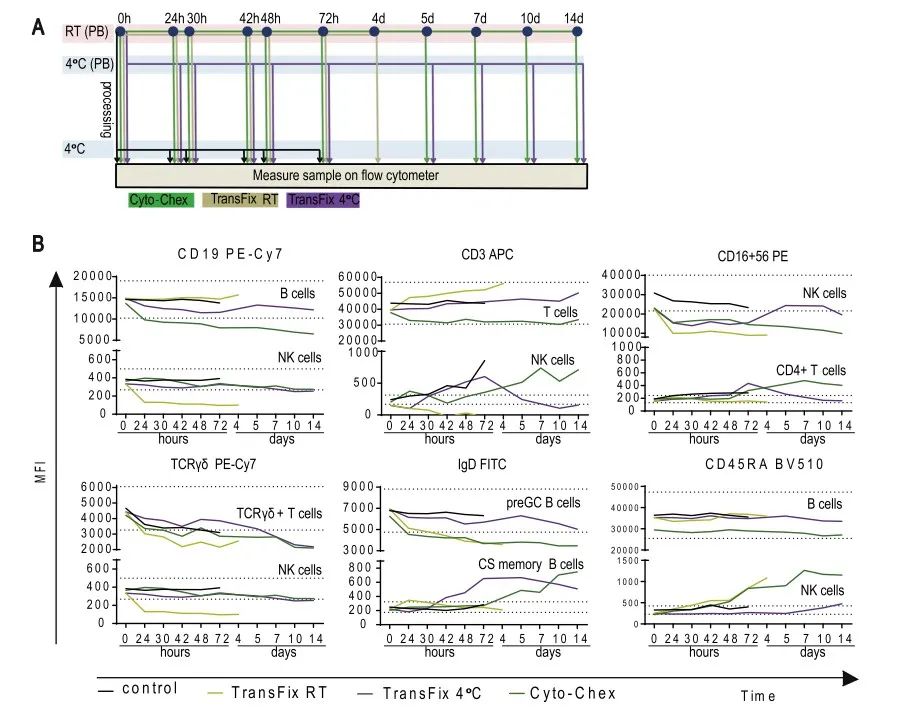
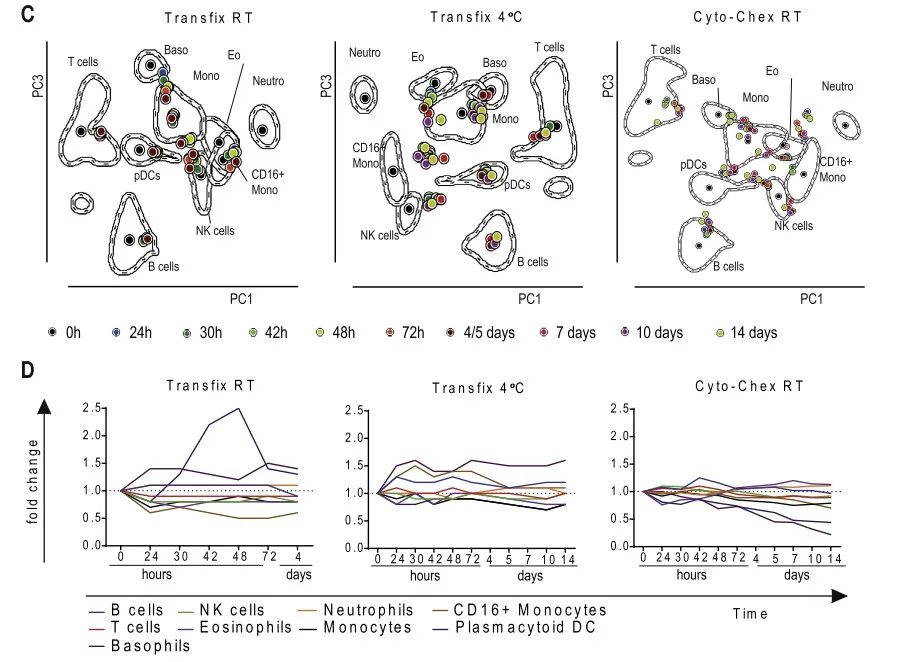
图4. cyto-chex 管和Trans-Fix管对流式结果的影响
如图A所示,测试了K3EDTA抗凝管,分别在4℃和室温保存24h,30h,42h,48h和72小时,然后进行抗体染色。总的来说,单核细胞在4℃条件下保存更好,对于其它类型的细胞室温条件下保存更好。对于细胞的绝对计数,差异主要来自于采取的检测方法,而不是保存的条件。从图E可以看出,使用Syxnex方法得到的结果相对稳定很多,而使用Perfect count方法,随着保存时间的延长,细胞的绝对数量一直在降低,保存72h,绝对数量降低至基线的70-80%。作者认为,造成两个方法结果差异的主要原因是Sysmex-X-300对细胞的处理步骤更少,而且对于死细胞的排除没有那么严格。更多结果请参考原文献。
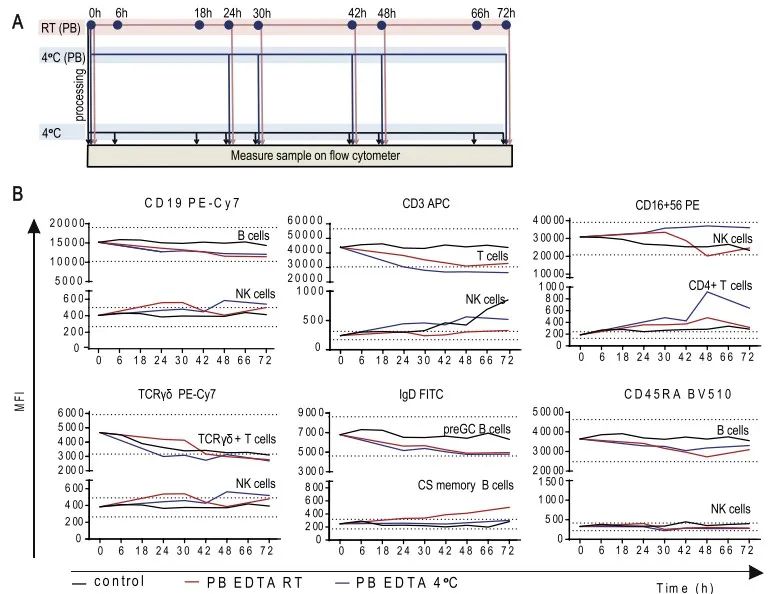
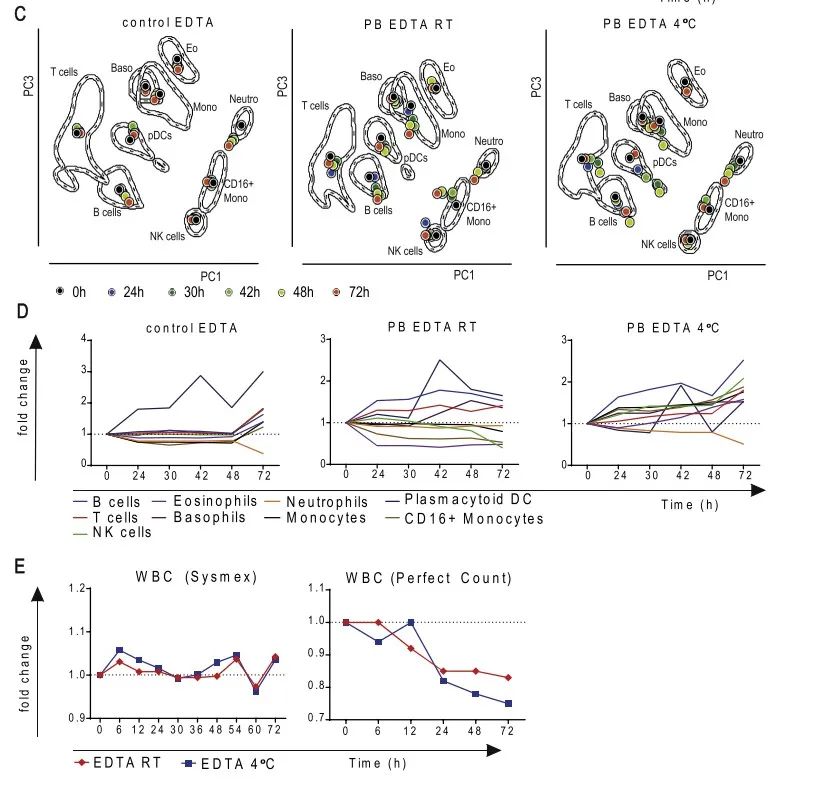
图5. 保存温度对流式结果的影响
如图A所示,使用K3EDTA抗凝管采血后立即染色,然后使用三种方式处理染色后的细胞,分别为不进行细胞固定,使用1% PFA进行处理,使用Fix&Perm Solution A (F&P) 进行处理,处理后,分别在4℃保存6h,18h,24h,30h,42h,48h,66h和72小时,保存不同的时间后,流式细胞仪进行检测。总的结论是,使用3种不同的处理方式,结果差异不大。更多结果请参考原文献。

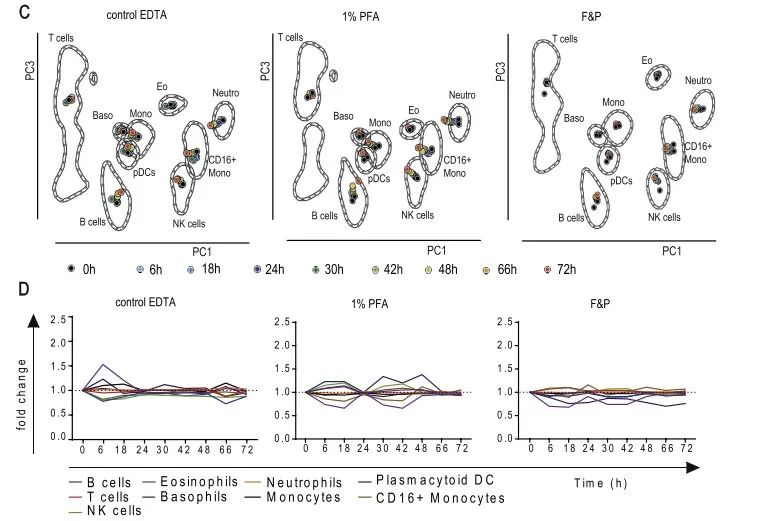
图6. 染色后处理方式对流式结果的影响
样品的稳定性验证是流式细胞术方法验证中非常重要的组成部分。本文中主要考虑了外周血使用不同的抗凝管,不同的运输和保存条件,保存时间以及染色后不同的处理方式和保存时间对于结果的影响。同样值得注意的是,同样的样品,用不同的检测方式,得到的结果同样可能有很大的差异。针对不同的项目,稳定性评价主要包括以上几个方面,但是针对每个实验流程,每个检测项目最适的条件都是不一样的,还是需要在参考相关文献和经验的基础上,做出合适的判断和选择。
在流式细胞术的临床应用中,情况会更加的复杂,因为检测项目的不同,可能还需要评价冻存PBMC,冻存的裂解红细胞后白细胞的稳定性,冻存全血的稳定性。
还有更为棘手的情况是,一些检测项目,在临床项目开始获得真实的样品前,是没有办法获得合适的样品的,只能使用模拟的样品进行稳定性评估。比如CAR-T相关的项目,只能采用将CAR-T细胞在体外加入外周血的方式进行模拟,而CAR-T细胞和外周血一般来自不同的个体,可能会因为个体差异引起CAR-T细胞与外周血中某些细胞的免疫反应,进而影响稳定性评估得到结果的可靠性。再比如细胞核内因子Ki67的检测,Ki67是细胞增殖的指标之一。使用健康人的外周血进行检测,Ki67的阳性率非常低,无法满足方法开发和验证的需求,只能使用先体外刺激PBMC的方式获得Ki67高阳性的细胞群,同样很难获得来自同一个供体的PBMC与外周血,为评价工作带来挑战。
遇到以上类似的情况时,我们更建议使用临床的真实样品进行稳定性相关的评估。这样得到的结果更加的准确,更能反映真实的情况。当然,使用临床的样品也存在一些风险,毕竟无法保证验证一定能够通过。这就需要决定使用临床的样品前,还是需要积累一些模拟样品的稳定性数据,为决策提供一定的信心和依据。
参考文献
2. Diks AM, Bonroy C, Teodosio C, Groenland RJ, de Mooij B, de Maertelaere E, Neirynck J, Philippé J, Orfao A, van Dongen JJM, Berkowska MA. Impact of blood storage and sample handling on quality of high dimensional flow cytometric data in multicenter clinical research. J Immunol Methods 2019 12;475
博主你好,请问有没有大鼠样本处理后稳定性的数据,我们做出来4小时CD8就降低超多
没有诶,做过小鼠、人和猴的,怎么会处理后样本稳定性降低很多呢?样本固定过吗?用的是偶联荧光还是,会不是是荧光素的稳定性导致
博主你好,请教您一下:如果我想测细胞的表面标志物,是不是要把细胞抗体混染,加Fc阻断剂,然后室温孵育15分钟就好。不用isotype的话,可以用什么进行对照呢?且问下博主中性粒细胞的离心力大概多少合适?
你好,表面marker可以混合加的,fc阻断剂在孵育抗体前加入,孵育十分钟左右,然后加入抗体混合物,室温孵育时间可以延长至30min,一般15min也够的,可以自行摸索一下做一下抗体滴度;你做isotype是为了确定阴性圈门还是什么?如果是,在没有isotype抗体情况下,可以做FMO(减一荧光对照,比如确定CD25阴性圈门,加入除CD25以外的其它抗体,这样理论上此时CD25对应通道应该是全阴性的)来确定阴性位置。
离心力我们一般都是400g/min,做的裂红全血,包括中性粒细胞