前言
常常听到流式操作的老师说,你细胞数量太少无法获取有效数据,或者细胞聚团导致管路堵塞等问题。本来就好不容易排到队去分析样本,还会被后面同学各种嫌弃,1min实验有时候10min都没做出来!细胞数目的掌握很难,过于稀释浓度不够,过于稠又会在通过细胞仪时影响分析,做不出结果,常常是我们做流式的一大通病。特别是从组织中分离样本时,这样的问题常常遇到。本期就看看如何从不同组织中分离出优质样本。
组织样本的单细胞制备
与贴壁或者悬浮细胞相比,组织样本的单细胞制备相对有一定的难度和复杂性,也是同学们最容易出现问题的地方,如细胞数量太少,细胞活性不好,细胞碎片太多等。下面就具体看看组织中的细胞如何制备。目前,最常用两种方法是物理法和酶解消化法。
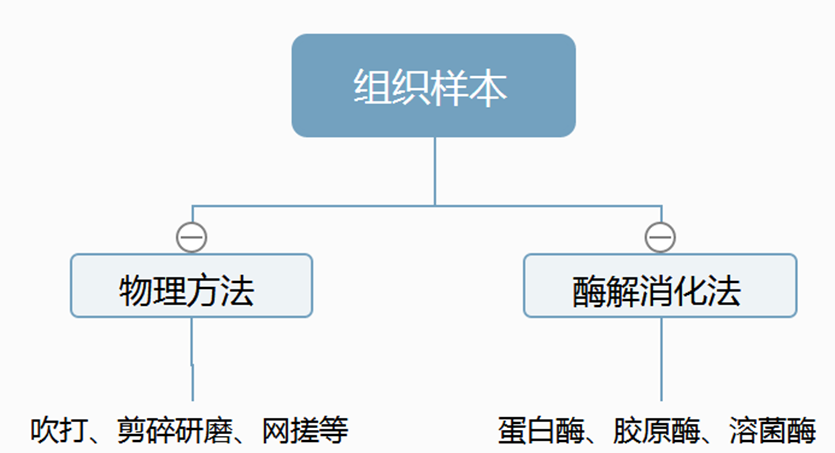
组织样本的处理方法
一、 物理方法:
• 原理:是指利用物理方法(机械法)分散组织,经过滤网过滤获得单细胞悬液。
• 应用:常用于处理部分软组织例如骨髓、胸腺、脾脏、淋巴结等,或富含细胞的肿瘤组织—-淋巴肉瘤、视神经母细胞瘤、脑瘤、未分化瘤、髓样瘤以及一些软组织肉瘤等,用单纯的机械法就可以获得大量高质量的单分散细胞。
• 优势:操作方便,耗时短,且能获得大量的细胞。
• 缺点:易造成组织细胞机械损伤,如细胞碎片和细胞团块,所以常与其他方法配合使用;对硬组织或纤维组织效果不好。
二、酶解消化法:
• 原理:利用酶(主要是胶原酶和蛋白酶)破坏组织间的胶原纤维、弹性纤维等、水解组织细胞的紧密连接结构的蛋白质和粘多糖物质以将实体组织分散为单个细胞的方法。
• 应用:既可用于普通单层的传代细胞也适合致密的组织样本,如上皮、肝、肾等或含有大量结缔组织的肿瘤—-食管癌、乳腺癌、皮肤癌等。
• 优势:适用于大部分组织样本获取单细胞,酶的种类多选择空间大。
• 缺点:操作步骤比较繁琐,消化时间比较长且难控制。不同的组织样本酶种类、浓度、消化时间的选择需要不断摸索优化。
下面具体介绍这2种方式的操作步骤:
一、物理方法
1. 吹打:用移液枪或注射器反复吹打组织以获得单个细胞的方法。应用于:骨髓、腹腔、肺等组织中相对比较游离的细胞(骨髓、巨噬细胞等)。
实例分享:骨髓液单个核细胞样本制备
1. 处死小鼠,喷洒70%的乙醇溶液消毒,拉扯双侧后腿直至听到清脆的响声(股骨从髋骨脱臼);
2. 将皮肤和肌肉剥离,露出股骨和胫骨,取出后至于70%乙醇溶液中消毒;。
3. 眼科镊夹住骨,无菌剪刀减掉骨两端,吸取生理盐水或PBS的注射器针头插入骨髓腔,反复冲洗骨髓到15ml离心管中;
4. 如骨髓溶液中红细胞较多,300g离心5min,弃上清,将室温的裂解液(ACK buffer)3ml加入细胞沉淀,悬混室温孵育3~5min;
5. 裂解后细胞悬液300g离心5min,弃掉上清;
6. 用细胞染色buffer或PBS重复洗1-2次;
7. 染色后、清洗、过滤,待上机检测;
2. 剪碎研磨法:用锋利的剪刀将组织剪碎后,并研磨以获得单个细胞的方法。应用于:脾脏、淋巴结、胰腺等新鲜组织。
实例分享:
(1) 将组织用PBS或无血清培养基漂洗干净;
(2) 将组织置于平皿中,用眼科剪剪成小颗粒(1~2mm3);
(3) 用注射器针芯或载玻片磨砂面研磨成匀浆;
(4) 滴加适量的PBS或无血清培养基,用移液器吹打混匀;
(5) 经100目细胞滤网过滤,300g离心5min,弃上清;
(6) 用细胞染色buffer(或含0.1%BSA的PBS)离心洗涤1~2次。
3. 网搓法:用100-300目的尼龙滤网固定于烧杯口,组织在网上轻搓,可用此法获得单个细胞的方法。常应用于:正常的组织、瘤组织、淋巴结等标本。
实例分享:
1. 将300目尼龙网扎在小烧杯上;
2. 把剪碎的组织放在网上,镊子固定并轻搓组织块,边搓边加PBS冲洗,直至将组织搓完;
3. 收集细胞悬液,300g离心5min,弃上清;
4. 用PBS等buffer离心洗涤1~2次。
二、酶消化法
1. 胰蛋白酶消化法:适用于消化间质较少的组织,如上皮、肝、肾等组织。
实例分享:
(1) 将组织块用无钙、镁离子的PBS漂洗干净;
(2) 将组织置于培养皿中,用剪刀剪成小颗粒(1~2mm3);
(3) 加入30倍组织量的酶溶液(0.1%胰蛋白酶和0.02%EDTA等比混合);
(4) 移液管转至50ml离心管中,置于37℃水浴或者恒温箱摇床中,消化20-60min;若需消化较长时间,可每隔15min将2/3的消化上清液转移到离心管中冰浴或离心去除消化液,加入含血清培养基终止消化,另补充新的消化液至离心管中继续消化;
(5) 将消化液或分批收集的细胞悬液经100目的滤网过滤,300g离心5min,弃上清;
(6) PBS等buffer离心洗涤1~2次;
(7) 染色,过滤准备上机检测。
2. 胶原蛋白酶消化法:此法适用于分离纤维性组织、上皮及癌组织,即纤维多的硬组织。钙、镁离子不会抑制消化作用,因此可用PBS或含血清培养基配制以提高细胞成活率。
实例分享:
(1) 将组织块用PBS漂洗干净;
(2) 置于培养皿中,剪成小颗粒(1~2mm3);
(3) 加入30倍组织量的蛋白酶溶液(0.1~0.3μg/ml的胶原蛋白酶);
(4) 移液管转至50ml离心管,置于37℃水浴或者恒温摇床中消化3-48h,后续过程具体方法同胰酶消化法。
例如:肝癌组织单个核细胞样本制备
1) 取实体肿瘤组织新鲜标本,迅速在无菌条件下放入RPMI-1640培养基中;
2) 去除坏死及脂肪组织,选取癌细胞集中和细胞活力较好的部位;
3) 用锋利的剪刀充分剪碎1-2mm3,将肿瘤组织转移至15-50ml的离心管中;
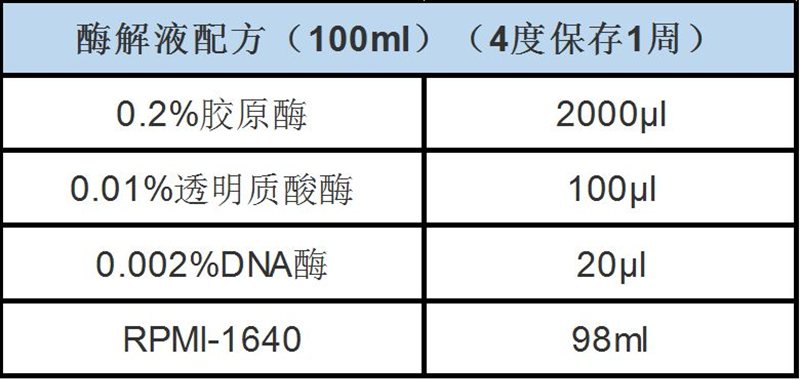
4) 看组织体积加入5-6倍的酶解液,37℃摇床消化30-120min左右,(如果用水浴锅消化,每隔5min就拿出来用吸管吹打一下使细胞分离);
5) 加入等量的含血清的培养基终止消化,用枪头反复吹打以获得单细胞悬液,过100目滤网过滤,去除剩余残渣,收集滤液,300g离心5min。
TIPs:
• 新鲜组织标本应及时进行处理保存,以免组织在室温下放置时间过长(24h内),产生中心组织坏死或者细胞自融,影响FACS测定结果;
• 不同的实体组织应选取不同的制备方法;
• 酶学法要注意条件的选择和影响因素,同时注意酶的溶剂、消化时间、pH值、浓度等方法对酶消化法的影响;如消化时间太短细胞消化不完全,消化太长会产生损伤;
• 如何判断消化成功?如发现组织块已分散而失去块状,经摇动可成为絮状悬液,可取出少量液体在显微镜下观察,可见分散的单个细胞和少量的细胞团,可认为消化充分。
• 在使用酶学方法时,应重视酶的选择,如含有大量结缔组织的肿瘤—-食管癌、乳腺癌、皮肤癌等,应选用胶原酶消化。
为了使大家对酶消化法理解更加透彻,特奉献上实验室的博士师兄师姐在样本制备中的protocol供大家参考:
1. 肠干细胞的样本制备(来自魏改改博士):
(1) 安乐死处死小鼠,取约5cm小鼠的小肠,纵向剖开后冷PBS洗净,平铺组织用盖玻片轻轻刮掉绒毛。
(2) 将洗净的小肠剪成3-5mm的碎块,转移至50ml无菌离心管内,加入15ml浓度为5mM预冷的EDTA,4度(或冰上)消化20-30min。
(3) 去掉EDTA上清,换成预冷的PBS,用移液枪持续吹打沉淀混合液并及时镜检,直至视野中出现大量小肠隐窝,静止1分钟左右,开始收集上清。
(4) 上清用70μM细胞滤筛过滤,重复收集上清3次后,800rpm,4度离心5分钟收集沉淀。
(5) 预冷的PBS重悬沉淀,600rpm离心,收集沉淀中含大量的隐窝。
(6) 1000U/mlDNA酶及1mg/ml的胰酶37度消化30min。
(7) 1200rpm/min离心5分钟后,PBS重悬细胞。
(8) 1-2μg/ml的碘化丙啶染色5min。
(9) 流式分析GFP绿色荧光细胞所占比例,死亡细胞通过碘化丙啶去除。
2. 皮肤表皮干细胞样本的制备(来自夏伟丽博士):
(1) 用手术镊、剪切取适量的皮肤组织,去除皮下脂肪组织,并用无菌PBS清洗。
(2) 真皮朝下,将皮肤展于0.25%的分离酶中,4度消化过夜。
(3) PBS清洗多余分离酶,用手术镊小心撕下表皮。
(4) 0.25%的胰酶37度消化30min。
(5) 无钙血清终止消化,1000r/min离心10min。
(6) 弃上清,并用PBS重悬沉淀,1000r/min离心清洗两次,每次5min(若杂质太多,可用40μm滤膜进行过滤)。
(7) 最后100μl PBS重悬,并用相应的荧光素标记抗体对表皮干细胞进行冰上避光,孵育标记30分钟,并设置相应的空白对照组、单染组和样品组。
(8) 用PBS进行清洗,1000r/min离心两次,每次5min。
(9) 300μl PBS重悬过滤,流式上机检测。
三、以上方法主要针对于大部分新鲜的组织样本,那么包埋组织的制备过程如何呢?
石蜡包埋组织的流式细胞样本制备:
外科手术获得的实体组织,大部分经过石蜡包埋处理。石蜡包埋组织单细胞分散方法的建立,扩大了流式细胞术的应用范围。
(1) 将石蜡包埋组织切成40~50μm厚的组织切片3~5片,或者用乳钵研成0.5mm直径大小的颗粒,放入10ml的试管中;
(2) 加入5~8ml二甲苯,室温下脱蜡1~2天,视石蜡脱净与否,更换1~2次二甲苯,石蜡脱净后,弃去二甲苯;
(3) 水化:依次加入5ml 的100%、95%、70%、50%梯度乙醇,每次10min;
(4) 去乙醇,加入蒸馏水3~5ml,10min后弃之;
(5) 消化:可加入2ml的0.5%胰蛋白酶(pH1.5~2.0)消化液,置于37℃恒温水浴中消化30min,在此期间,每隔10min用振荡器振荡1次;
(6) 消化30min后,加入含血清培养基终止消化;
(7) 经300目尼龙网过滤,未消化好的组织可进行第二次消化;
(8) 收集细胞悬液,300g离心5min,弃上清。
转自:公众号耀邦实验室
老师您好,请问肺组织应当怎么操作呀?
您好 我可以询问一下,如果我使用液氮中的心脏组织,可以用这些方法吗
您好,请问骨髓细胞在加不加红细胞裂解液裂解的情况下,对流式结果影响很大吗?或者如何判别其中红细胞多少,是肉眼观察骨髓冲洗液是否呈现红色吗(因为我之前都没有裂红,担心结果会不会不可信)?
请问有肺组织的处理流程吗?
你好,我想问一下如果我想检测牡蛎的鳃组织中细胞里面的物质,不想要细胞间隙中的,那我应该用胰蛋白酶消化法吗?
嗯嗯 肯定需要酶解 得查一下胰酶是否合适,还有其它酶
请问脑组织采用哪种方法比较好?我之前用的是胶原酶消化法,但是结果并不好,现在非常迷惑
你好,这个我也不清楚,没做过,可能需要你自己摸索一下。一般酶解不充分的话 可以机械加酶解,如果没有哪种专门制备单细胞的组织研磨器可以考虑用纱网
好的,我也用了机械加酶解,并且用了专门的滤网,结果还是不行,我再继续摸索一下,谢谢!
你好,请问可以问下你的脑组织方法摸索的怎么样了吗,求分享!感谢感谢
请问您摸索到合适的脑组织消化方法了嘛~
请问您摸索到合适的脑组织消化方法了嘛~
请问肠道组织比较适用哪种处理办法?
您好 我没有做过肠道组织,不是很清楚诶 不过这种组织直接机械法很难,有韧性,建议可以先酶解,不充分的话再结合机械
好的,谢谢!
肠道组织可以先用胶原酶D酶解,然后再轻轻研磨,需要注意的是要把周围的脂肪组织去除干净,不然会影响肠道组织提取效果
好的,感谢!请问小鼠和人体组织都是这样处理吗?
没有做过人体组织,动物组织基本是这样处理的
好的好的,非常感谢!
请问大神有脾脏组织流式的处理流程嘛
大部分组织都可以参考这个方法 我们以前做脾脏是组织研磨器,然后过滤之后上机
感谢!