6xHis标签简介
6xHis标签,也称为多组氨酸标签(polyhistidine ),His6标签或hexa组氨酸标签,这是一种在转染的细胞中目标蛋白的C端或N端上由至少6个组氨酸残基链接上所组成的氨基酸序列,它的序列如下所示:
碱基序列:
CATCATCATCATCATCAT
或
CACCACCACCACCACCAC
氨基酸序列:
HHHHHH
6xHis标签的优点
相对小的分子量,低的免疫原性,亲水性和在去污剂和其他添加剂存在的情况下的易变性,因此在天然和变性的条件下,多组氨酸标签是被公认为最广泛使用的亲和标签用于一系列的蛋白纯化目的。
可以检测和纯化重组蛋白而无需使用蛋白特异性的抗体或探针,同时抗His标签抗体的存在用于His标签蛋白的检测中使6xHis标签更加的普遍和受欢迎。
His标签的用途
1. 亲和纯化蛋白
6xHis标签通常在重组蛋白的纯化中使用,这是因为组氨酸残基的序列可以在特定的缓冲液条件下结合到几种类型固定的离子上(比如镍,钴和铜),从而达到容易检测和纯化His标签蛋白的目的。例如在大肠杆菌和其他原核系统中表达的多组氨酸标签重组蛋白通常使用固定的金属离子亲和色谱来纯化或称为IMAC,IMAC的全称是 immobilized metal-affinity chromatography,即固定金属亲和层析。
亲和的意思就是指采用抗原-抗体之间的特异性结合来分离出自己的目标抗原或抗体。
IAMC一种非常有效的分离技术,它利用组氨酸能够与金属离子发生亲和作用的原理对蛋白质加以分离。例如伯乐的Profinity IMAC 介质以UNOsphere™ 为基质,含有作为二价、三价金属离子螯合配位体的亚氨基二乙酸 ( IDA )。当配位体结合有 Zn2+、Ni2+ 或 Cu2+ 等金属离子时,含组氨酸的蛋白会与此层析介质结合。
在亲和层析过程中,支撑物(通常是珠状琼脂糖凝胶或磁珠颗粒)用合适的耦合试剂来进行衍生,比如氨三乙酸nitrilotriaceticacid(NTA)或亚氨乙酸iminodiaceticacid(IDA)。这些螯合的基团会固定所需要的二价金属离子(比如镍,铜,钴和锌),从而这些金属离子最后负责结合和分离混合液蛋白中的目标分子。在选择使用哪个配基上,你需要考虑IMAC树脂的结合能力主要取决于被纯化蛋白的性质和在纯化过程中所使用的金属离子。
镍,钴,铜是进行纯化His标签蛋白首选的被广泛使用的离子,由于它们在水溶液中对于组氨酸和半胱氨酸良好的亲和性。在这三个离子中,镍是最广泛使用的金属离子,它呈现出最高的亲和性和选择性对于His标签蛋白.然而,它也会非特异性的结合包含组氨酸群的内源蛋白。而钴提供最特异性的结合和组氨酸标签因此当纯度是首要选择时钴是二价阳离子的首选。铜离子和镍钴离子相比和His标签蛋白的结合非常强劲,但是它的特异性在三种离子中是最弱的。由于这个原因,当纯度不是最主要的目的时铜离子IMAC被使用。
在制备样品时,细胞被捕获和裂解通过酶法或机械条件。因为多组氨酸标签在生理PH值和离子强度下很好的结合到IMAC树脂上。结合在几乎中性缓冲液的条件下完成。大部分科研人员使用包含10-25mM咪唑的TBS溶液作为结合/漂洗缓冲液来防止带有组氨酸残基内源蛋白的非特异性的结合.被捕获的组氨酸标签蛋白的洗脱和回复通常使用增加的咪唑浓度(至少200mM)来实现,低PH值或一个过量的强螯合剂比如EDTA。
2. 检测目标蛋白
ELISA或免疫印迹检测:可以使用镍螯合的辣根过氧化物酶来进行基于HRP组氨酸标签蛋白的检测而无需使用抗体。同时,抗6xHis的抗体是高度灵敏和特异性的对于那些含有组氨酸标签的蛋白。
凝胶染色:几种免疫分析方法利用多组氨酸标签通过抗多组氨酸标签抗体或通过SDS-PAGE来检测靶蛋白。
3. 蛋白相互作用
蛋白相互作用pull-down:镍琼脂糖树脂可以用于纯化,鉴定和检测组氨酸标签蛋白的相互作用。
文献解读
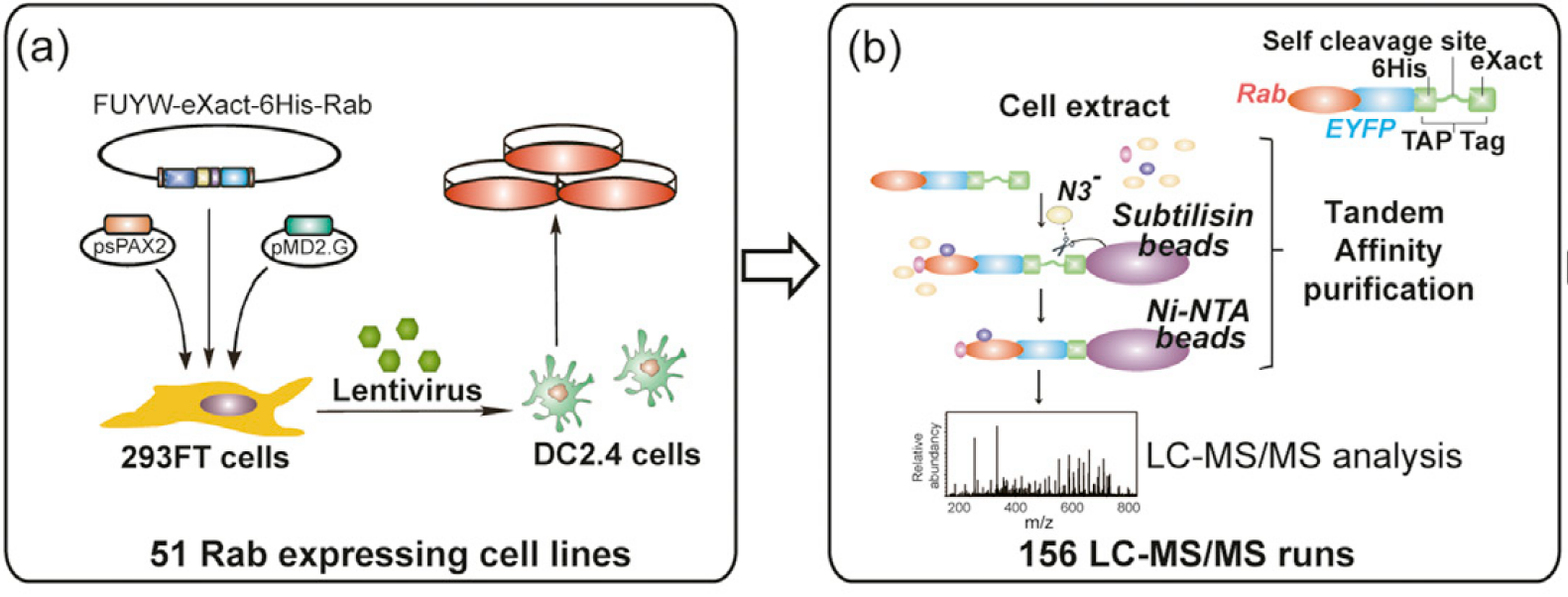
上面的图片来源于2016年发表在《Immunity》上的Analysis of the Rab GTPase Interactome in Dendritic Cells Reveals Anti-microbial Functions of the Rab32 Complex in Bacterial Containment,文献中就采用了6xHis标签来纯化Rab蛋白,只是文献中为了提高蛋白相互作用的可信度,提高蛋白的纯化效果,采用的是2个标签的纯化方法。
从(a)图中可以看到FUYW-exact-6His-Rab字样,这说明在Rab分子的N端加上了一个6xHis标签与eXact标签,eXact标签是一个能够自割切的枯草杆菌结构蛋白。在(b)图中我们可以继续看到,6xHis与Rab分子之间还加上了一个EYFP标签,这主要是为了方便构建慢病毒稳转细胞时筛选,因此文献中还提到了使用空的EYFP质粒来做了阴性对照。
文献中做蛋白相互作用的大致流程如下所示(其实图(b)就是纯化蛋白的过程):
- 构建稳定表达的
eXact-6xHis-EYFP-Rab整合蛋白的DC2.4细胞; - 通过
eXact-6xHis两个标签进行亲和纯化,其中eXact这个标签的特征在于它无需抗体进行纯化,因此就会降低引入高浓度外源抗体对质谱分析的影响,当溶液中的N3-离子浓度升高后,就会诱导eXact标签与目的蛋白之间的酶切,从而导致eXact标签被固定的蛋白酶滞留在介质上,此时洗脱下来的就是6xHis-EYFP-Rab重组蛋白; - 使用Ni-NTA纯化柱来纯化
6xHis-EYFP-Rab蛋白。
参考资料
- 6xHis 标签的特点以及它的使用方法
- Purification of proteins by IMAC
- Janeway’s Immunobiology 9th
- Profinity IMAC 树脂
- Analysis of the Rab GTPase Interactome in Dendritic Cells Reveals Anti-microbial Functions of the Rab32 Complex in Bacterial Containment