目前有近20%的外泌体相关课题集中在外泌体作为药物载体方面的研究,从已发表的相关文章来看,研究主要集中在外泌体的载药类型和载药方式上:
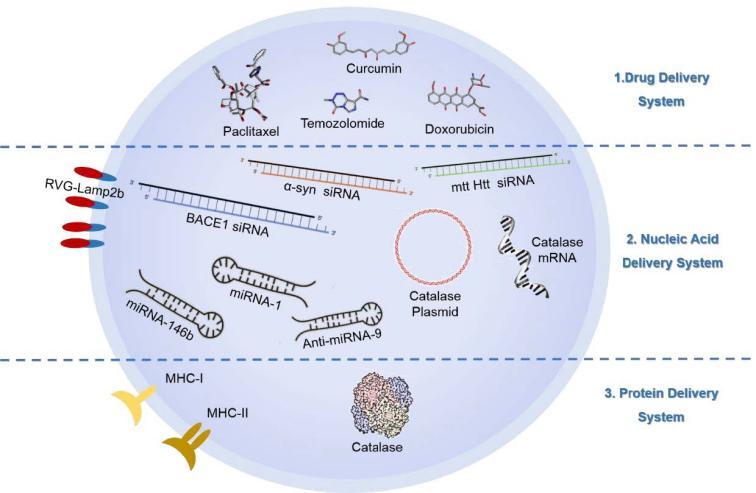
一、 外泌体的载药类型主要分为三大类:药物分子、核酸和蛋白。
J Control Release. 2017 Sep 28;262:247-258.
1. 药物递送系统:doxorubicin, paclitaxel, curcumin, temozolomide
2. 核酸递送系统:siRNA, miRNA, mRNA, DNA plasmid
3. 蛋白递送系统:catalases
二、 外泌体的载药方式:
J Control Release. 2017 Sep 28;262:247-258.
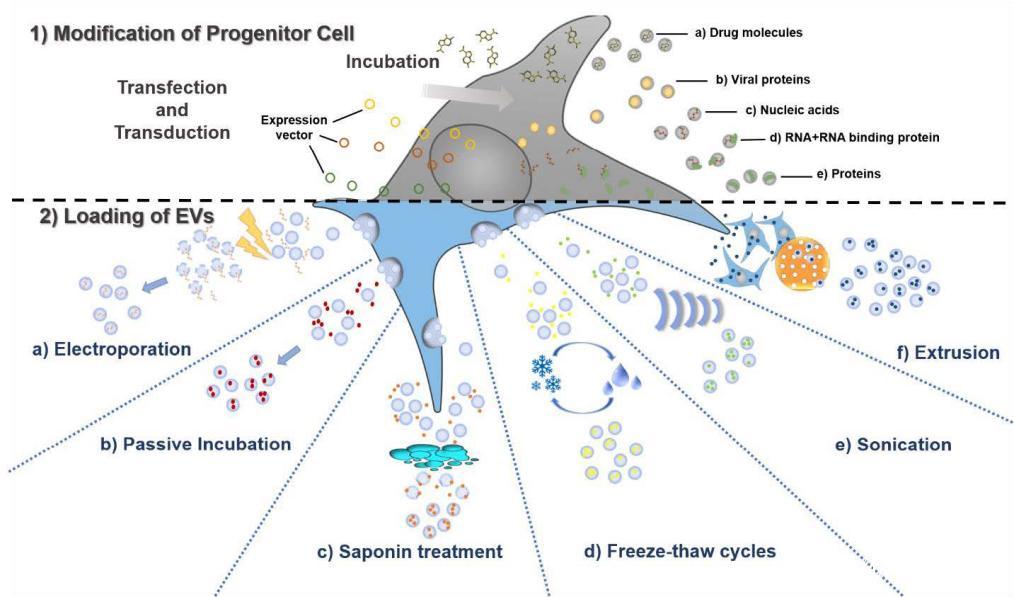
1. Pre-loading: 内源性装载。在生物发生过程中,亲本细胞产生外泌体之前,就可以把治疗分子在外泌体生成过程中整合到外泌体内。让细胞成为我们载药外泌体的活工厂,直接生成我们想要的外泌体。
为了让大家进一步了解内源性外泌体装载的机制,小刀为大家精心挑选了三篇文献:
1) Effects of exosome-mediated delivery of myostatin propeptide on functional recovery of mdx mice (Biomaterials. 2020 Apr;236:119826)
作者为了检测外泌体作为前肽递送载体的可行性,进行了以下相关实验:
构建编码前肽抑制域的融合蛋白,将其插入至外泌体跨膜CD63的第二细胞外环当中,使得前肽可表达在外泌体的表面
转导表达前肽的慢病毒(CD63-propeptide-expressing lentivirus)进小鼠胚胎成纤维细胞(NIH3T3),生成表达前肽的外泌体(EXOpro)
小鼠腹腔注射EXOpro,表达前肽的外泌体能够特异性的与野生型小鼠血清中成熟的肌生成抑制素相结合,从而发挥相应的治疗作用
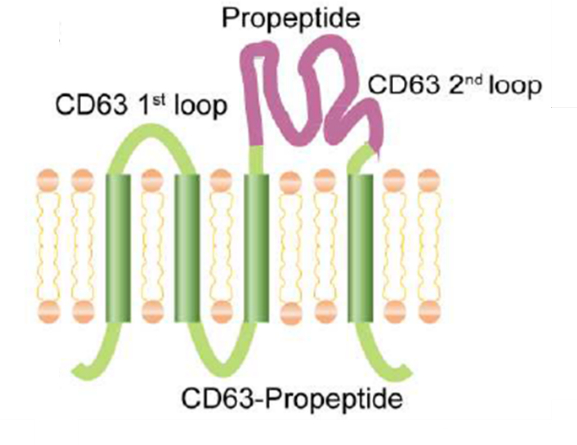
前肽表达载体构建示意图
2) Exosome-based delivery of super-repressor IκBα relieves sepsis-associated organ damage and mortality (Sci Adv. 2020 Apr; 6(15): eaaz6980.)
EXPLOR系统:装载蛋白的外泌体通过光可逆系统进行蛋白-蛋白互作(该系统早在Nat Commun. 2016 Jul 22;7:12277 有过发表)
设计两种蛋白表达载体,构建可以稳定表达CIBN-EGFP-CD9 和srIκB-mCherry-CRY2两种重组蛋白的细胞株
利用460nm的蓝光照射,诱导细胞主动将抗炎性蛋白装载至外泌体中,从而进行可控的蛋白互作
EXPLOR系统优势:可轻松携带需要的重组蛋白,不需分离纯化;经基因改造的细胞可简单便捷的生产目的外泌体,在外泌体蛋白治疗商业化中有巨大潜力;可与个性化治疗兼容,生产根据患者定制的药物递送系统,从而减少宿主免疫反应
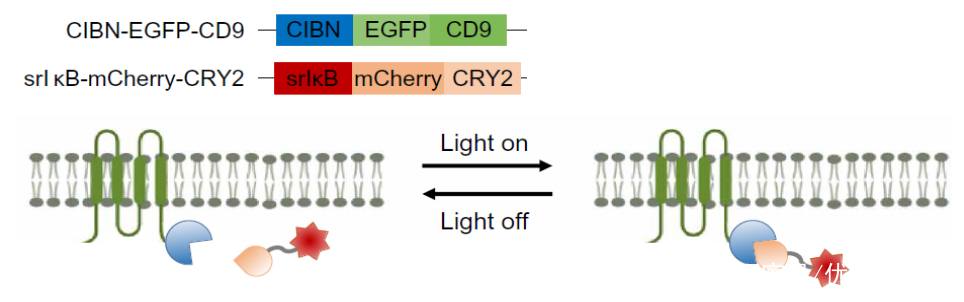
生成Exo- IκBα的质粒载体结构图;融合蛋白及其活性示意图
3) In vivo self-assembled small RNAs as a new generation of RNAi therapeutics (Cell Res. 2021 Jun; 31(6): 631–648.)
基于体内自组装外泌体siRNA的策略,实现了siRNA从表达到装载再到递送的全体内自动化过程
体外构建可表达siRNA的基因环路,灵活的实现多个siRNA和靶向肽段的插入
核心环路:不带靶向标签,用于系统性siRNA的递送
自组装环路:带靶向标签,用于靶向性siRNA的递送
可编辑基因环路的优势:利用宿主自身器官分泌的外泌体作为载体,解决了siRNA递送载体带来的免疫源性和毒性问题;对基因环路的灵活编辑,可同时传输多个siRNA,对疾病进行多靶点打击;特异性的靶向肽段可高效的将siRNA输送到特定的组织,克服血脑屏障等生物屏障的制约
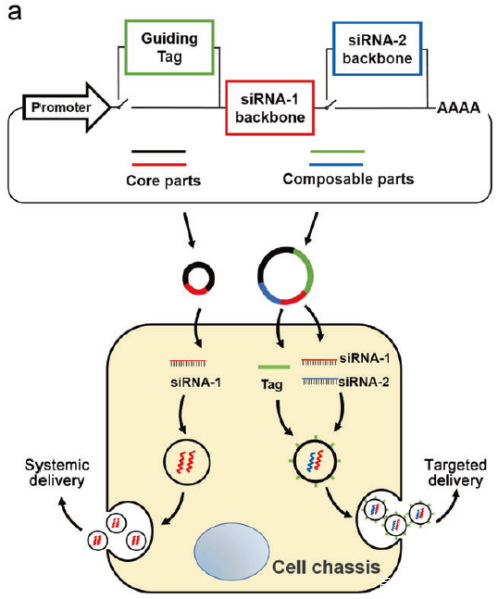
基因环路结构构建示意图
2. post-loading: 外源性装载。
在分离天然外泌体后,对收集到的外泌体进行相应的药物装载,分为多种不同的装载方式:
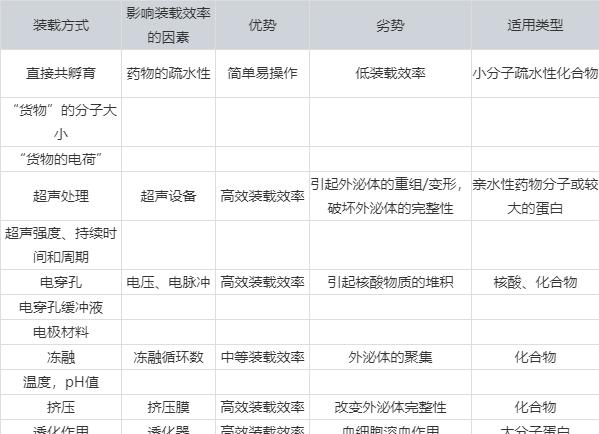
外泌体作为药物载体虽有诸多优势,但仍存在不少挑战,比如说外泌体的纯度和质量,外泌体的产量,外泌体的最佳储存条件等。目前的技术条件还是相当有限,亟待更新的技术去克服这些困难。