基本定义:将肿瘤细胞注射到动物原位器官组织内,形成原位肿瘤病灶,是研究肿瘤生长和转移的经典动物模型。
模型优点:为肿瘤提供了最适宜的生长环境,能较好的模拟人体内肿瘤的发生、发展、侵袭及转移的全过程。
举例:以乳腺癌为例,如下图所示,临床中乳腺癌从原位向肺,骨,脑等器官转移。
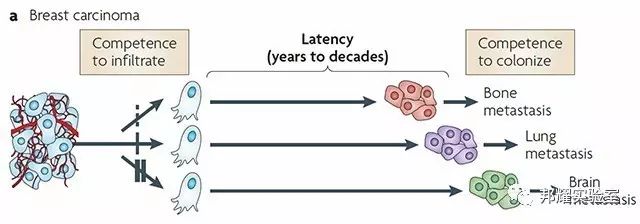 图1.乳腺癌常见的转移器官[1]
图1.乳腺癌常见的转移器官[1]
下面为大家介绍乳腺癌原位注射的步骤:
1. 准备步骤
-
细胞系选择:临床中高侵袭性且带有荧光素酶(Luciferase)标签的三阴性乳腺癌细胞:MDA-MB-231-Luc、4T1-Luc,可在IVIS小动物活体光学成像系统上直观地检测原位肿瘤细胞向内脏器官的转移情况。
-
细胞接种量:每只注射50μL含有1×105个4T1-Luc(小鼠)或2×106MDA-MB-231-Luc细胞(裸鼠)。
-
小鼠品系的确定及数量:6-8周龄BALB/c雌性小鼠或者裸鼠,每组10只。
-
其他准备器材:冰盒、麻醉剂阿佛丁,注射器,剃毛器,75%酒精棉球,灭菌手术剪和手术镊,医用缝合针线、手术保温机。
2. 操作步骤
-
胰酶消化处于对数生长期的4T1-Luc细胞,离心后用PBS清洗细胞以除去培养基中残留的血清成分,并再次离心。
-
用适当的PBS重悬细胞调整其密度至1×105个4T1-Luc/50μL,放置在冰盒中待用。
-
①麻醉:向BALB/c雌性小鼠腹腔注射300μL麻醉剂阿佛丁,放置5min待小鼠完全麻醉;
②剃毛并消毒:用剃毛器对小鼠第四对乳房区域脱毛,并用酒精棉球擦拭 消毒;
③剪开表皮找到第四对乳房垫位置:用手术剪在离乳头1cm处剪开表皮,找到乳头下层的乳房垫;
④注射细胞:用镊子挑起乳房垫组织,向乳房垫注射50μL细胞悬液;
⑤缝合并复苏:医用缝合针线缝合伤口,酒精棉球轻轻擦拭后,将小鼠放到预热好的37℃手术保温机上等待其复苏。整个操作过程遵循无菌操作原则。
请观看下面视频,乳腺癌原位注射过程:
3. 后续分组和试验分析
注射细胞后第二天,小鼠腹腔注射荧光素酶的底物,用气麻机将小鼠麻醉后,IVIS小动物活体成像系统检测小鼠乳腺肿瘤细胞上的生物发光值。以此为分组依据,根据实验要求将小鼠均分为DMSO对照组和药物处理组,每组10只小鼠。
每周利用IVIS检测小鼠乳腺癌的原位生长和远端转移的情况。约第4周时结束实验,活体IVIS拍照后颈椎脱臼处死小鼠,并将小鼠的主要器官包括脑,心脏,肾,肝脏等取出,置于IVIS拍照,检测肿瘤的自发转移。
如下图:给BALB/c雌性小鼠原位注射腺癌细胞4T1-Luc后,乳腺癌细胞远端转移到肺部。
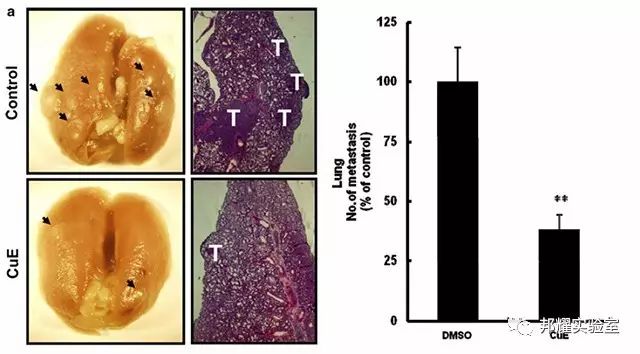 图2.乳腺癌原位注射4T1-Luc后发生肺部转移[2]
图2.乳腺癌原位注射4T1-Luc后发生肺部转移[2]
基本定义:如下表所示,肝脏是各种恶性肿瘤经常发生转移的脏器[1]。小鼠肝转移模型是将肿瘤细胞注射在脾脏后通过血液循环转移到肝脏,该模型是研究恶性肿瘤肝转移机制和抗转移治疗的重要模型。

模型优点:肿瘤转移率较高,模拟临床中肿瘤切除术后癌细胞回流入门静脉至肝脏血道播散而发生肝转移的过程。
举例:结合上图结肠癌后期易发生肝转移,以结肠癌为例。
下面为大家介绍脾脏注射的步骤:
1. 细胞系和小鼠的准备
-
细胞系的选择:常选择临床中腹腔内淋巴结转移病灶来源的SW620细胞,远处转移灶来源的LoVo细胞,转移性强的鼠源CT-26细胞。同时,可构建带有荧光素酶(Luciferase)标签的细胞(SW620-Luc、LoVo-Luc、CT-26-Luc),利用荧光素酶与荧光素作用时生物发光的原理,在IVIS小动物活体光学成像系统上直观地检测脾脏中的肿瘤细胞向肝脏转移的情况。
-
细胞接种量及稀释:以CT-26-Luc细胞为例,每只小鼠注射50μL含有1×106个CT-26-Luc细胞的细胞悬液。
-
小鼠品系的确定及数量:BALB/c小鼠,每组10只
-
其他准备器材:冰盒、麻醉剂阿佛丁,注射器,剃毛器,75%酒精棉球,灭菌手术剪和手术镊,医用缝合针线、手术保温机。
2. 操作步骤
-
胰酶消化处于对数生长期的CT-26-Luc细胞,离心后用PBS清洗细胞除去培养基中了残留的血清成分,并再次离心。
-
用适当的PBS重悬细胞调整细胞密度至1*106/50μL,放置在冰盒中待用。
-
①麻醉:向8周龄大的雄性(排除雌鼠激素干扰)BALB/c小鼠腹腔注射300μL麻醉剂阿佛丁,放置5min待小鼠完全麻醉;
②剃毛并消毒:用剃毛器对小鼠左肋下方脱毛处理,酒精擦拭消毒;
③暴露脾脏:用手术剪在左肋下方处剪开表皮和腹膜打开约1cm的伤口,进腹暴露脾脏后,将脾下极轻柔地提出腹腔;
④注射细胞:沿脾脏进针1.5cm左右,缓缓注入50μL细胞悬液,用酒精棉球按压针眼2min;
⑤缝合并复苏:医用缝合针线缝合伤口,酒精棉球轻轻擦拭后,将小鼠放到预热好的37℃手术保温机上等待其复苏。整个操作过程遵循无菌操作原则。
请观看下面视频,脾脏注射模型的构建过程
3. 后续分组和试验分析
注射细胞后第二天,小鼠腹腔注射荧光素酶的底物,用气麻机将小鼠麻醉后,IVIS小动物活体成像系统检测小鼠结肠肿瘤细胞上的生物发光值。以此为分组依据,根据实验要求将小鼠均分为DMSO对照组和药物处理组,每组10只小鼠。
对照组和加药组分别每天腹腔注射50μLDMSO和药物。每周利用IVIS小动物活体成像系统检测小鼠结肠癌细胞在脾脏生长和肝脏转移的情况。第4周时结束实验,活体IVIS拍照后颈椎脱臼处死小鼠,并将小鼠的脾脏、肝脏及有转移的其他组织取出,置于IVIS拍照,检测肿瘤的转移情况。
如下图为,BALB/c小鼠脾脏注射结肠癌细胞CT-26-Luc后,癌细胞发生了肝转移。
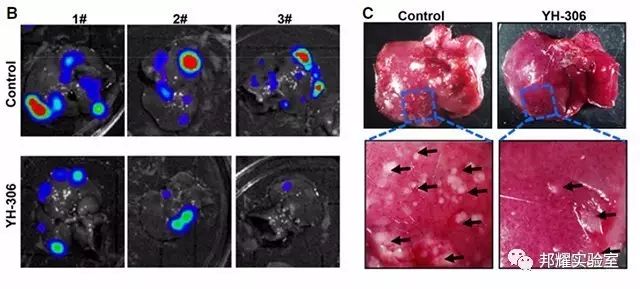 图3.IVIS和拍照显示的结肠癌的肝转移[3]
图3.IVIS和拍照显示的结肠癌的肝转移[3]
1、麻醉剂阿佛丁300μL的用量可根据小鼠的品系和大小进行调整,但不可注射过量,防止小鼠复苏时间过长或者麻醉死亡。
2、脾脏中血管丰富,注射后需多按压一段时间,防止血液外渗造成小鼠大量失血而死亡,或者注射到脾脏的肿瘤细胞外渗。
3、脾脏器官较薄,需沿着脾脏平行进针,防止针口戳穿脾脏。
在肿瘤发生的过程中,90%以上的患者是死于晚期肿瘤转移及其并发症。肿瘤转移动物模型是研究癌症发病病因和机理的重要手段,对模拟临床中人体肿瘤转移过程有着非常重要的作用。
良好的动物模型的应该有简便易行、实验周期短、成功率高、重复性好、模型性质稳定等优点。根据不同研究目的和不同癌症类型,合理选择最合适的肿瘤转移模型对于肿瘤致病机理研究与临床诊断和治疗都有重要意义。
参考文献
[1] Nguyen D X, Bos P D, Massague J, et al. Metastasis: from dissemination to organ-specific colonization[J]. Nature Reviews Cancer, 2009, 9(4): 274-284.
[2] Zhang T, Li J, Dong Y, et al. Cucurbitacin E inhibits breast tumor metastasis by suppressing cell migration and invasion.[J]. Breast Cancer Research and Treatment, 2012, 135(2): 445-458.
[3] Dai F, Chen Y, Huang L, et al. A novel synthetic small molecule YH-306 suppresses colorectal tumour growth and metastasis via FAK pathway.[J]. Journal of Cellular and Molecular Medicine, 2015, 19(2): 383-395.
请问肿瘤转移模型的建立一定需要免疫缺陷鼠吗,比如说我想通过尾静脉注射建立肺转移模型