稳定细胞株构建的主要流程及关键点分析:
众所周知VSVG包膜蛋白能够感染多数细胞,但是对于不同种属、不同组织来源的细胞,慢病毒的感染性是有很大差别的。像一些神经细胞、淋巴细胞、树突状细胞等,慢病毒感染效率低。
MOI(multiplicity of infectin),感染复数,含义为感染时病毒和细胞数量的比值。比如细胞接种量为1×104/孔,MOI为10,慢病毒的滴度为1×108TU/ml,那么每孔加入慢病毒的量为1µl。
那如何确定病毒感染目的细胞的MOI呢?多数细胞查阅文献也能获得推荐的MOI,但不同实验室,不同病毒测算出的MOI也有差别。所以建议根据自己包装的慢病毒重新检测MOI。简要步骤如下:
(1)目的细胞正常传代,接种96孔板,按细胞的生长速度来确定接种量,一般情况以72h长满单层为标准;
(2)根据测定的慢病毒滴度,进行病毒的稀释;
(3)MOI设定1、5、10、20;
(4)96孔板中的细胞过夜培养后,换液加病毒,同时加入终浓度为8µg/ml polybrene;
(5)3天后观察荧光比例;
(6)以80%细胞发荧光来评价最佳MOI。
注意:
(1)细胞接种的密度,太稀有可能细胞会死亡,太密不利于后面的荧光观察。96孔板大部分细胞可以接种1-5×103/孔,具体接种量要根据不同细胞的生长速度来确定;
(2)Polybrene的浓度也需要根据不同的细胞去调整,有些细胞比较敏感,可以不加;
(3)对于MOI的分组设置也需要根据不同细胞去调整,大部分癌细胞可以根据上面的比例去设置,但有些难感染的细胞可能需要增加到100个MOI。
通过上述实验确定了慢病毒感染目的细胞的最佳MOI,接下来就可以进行稳定细胞株的筛选工作了。
将目的细胞接种24孔板,控制好细胞密度,贴壁后大约为30%-40%左右的密度;
细胞过夜培养后,按最佳MOI加入病毒,同时加入终浓度为8µg/ml polybrene。
注意:
(1)目的细胞的接种密度,以接种病毒后48h长成单层为标准;
(2)Polybrene的浓度根据不同细胞去调整;
(3)用24孔板来进行实验,主要是为了节约病毒的使用量。也可以直接拿上一步96孔板中的细胞进行后续实验;
(4)对于极难感染的细胞,比如淋巴细胞之类的,需要进行特殊方法感染,后期会有相应专题来讲解。
(1)细胞感染病毒48h 后,荧光显微镜下观察荧光细胞比例;
(2)对24孔板细胞进行传代,根据细胞生长速度由一个孔分成3-5个孔,过夜培养。同时也接种正常的未感染病毒的目的细胞;
(3)根据包装的慢病毒载体上的筛选抗生素,进行加压筛选,这里以嘌呤霉素为例;
(4)不同细胞对嘌呤霉素的敏感程度也不一样,所以需要设浓度梯度。本实验室的经验是从1µg/ml到10µg/ml去设立3-5个浓度梯度;
(5)再培养24-48h后观察细胞的死亡情况,选择最佳的嘌呤霉素浓度孔细胞进行后续实验;
(6)后期根据细胞的生长速度和生长情况,可以适当增大或减少嘌呤霉素的浓度;
(7)待细胞长满后进行扩大培养,用于检测目的基因的过表达或者干扰情况;
(8)检测正确后进行细胞的培养冻存或者继续进行单克隆细胞株的筛选。
注意:
(1)嘌呤霉素最佳浓度的确定:首先是正常细胞必须全部死亡,其次就是根据各孔细胞死亡情况来确定,一般选择死亡超过50%,细胞生长速度较其它孔不会明显降低。因为细胞死亡少的话可能会有很多低表达量的细胞存在,如果细胞死亡过多,也会导致细胞扩增很慢,不利于快速获得稳定细胞株;
(2)嘌呤霉素的浓度设置,可以去参考文献,根据文献推荐的浓度来进行梯度设置,如果没有文献支持,可以多设置梯度去筛选;
(3)选择了最佳的嘌呤霉素浓度,不代表后面一直用这个浓度,要根据细胞的生长情况来判断,适时的去增减嘌呤霉素的浓度;
(4)细胞长满后尽快扩大培养去检测目的基因的表达情况,检测方法一般是qPCR和WB;
(5)可以根据实验目的选择是否要进行单克隆细胞株的筛选。
如何获得高表达或者高干扰效率的单克隆细胞株,是很多科研工作者比较头疼的事情,往往单克隆细胞株的过表达或干扰效率比混合克隆差。
在这里,作者想说混合克隆和单克隆各有优缺点。混合克隆制备周期短,过表达和干扰效果往往也很好,但随着传代次数的增加,过表达和干扰效果可能会下降;单克隆细胞株传代方面会比混合克隆好,但其制备周期长,检测成本也翻很多倍。因为如果想要获得一株高表达或者高干扰的稳定株,需要筛选很多单克隆细胞去进行检测,工作量会增大很多倍。
所以如果想获得效果好的单克隆细胞株,建议是增加筛选的总量。很多研究者正是因为筛选总量不够,或者的单克隆细胞株数量有限,也就导致了很难筛到效果好的细胞株。
常规的筛选单克隆细胞株有两种方法,原理是一样的,操作上有些区别。
(1)有限稀释法:将鉴定正确的混合克隆细胞株进行传达计数,然后将细胞稀释到每10ml 50个细胞。再将细胞悬液接种96孔板,一般情况建议接种4块,便于后续筛选到效果好的单克隆细胞株;
(2)第二种方法原理一样,操作是:A1孔接种1000个细胞,纵向往下倍比稀释,然后所有的第一列细胞再横向倍比稀释。同样建议接种4块96孔板。
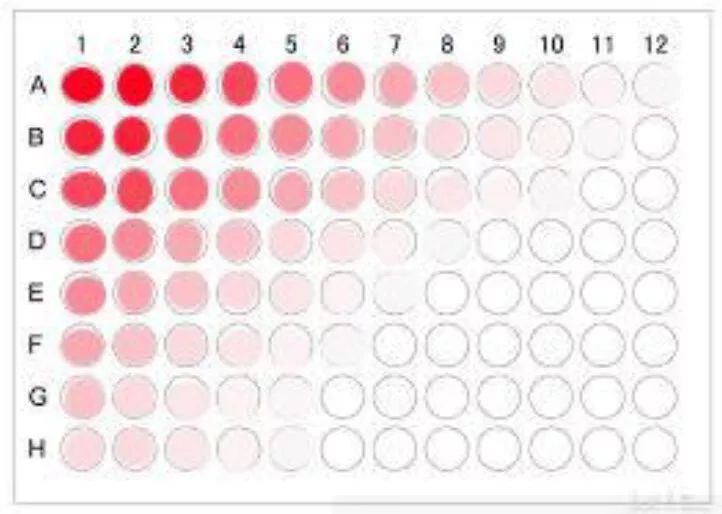
两种方法都需要培养数天,并且需要不断观察,找出只有单个细胞增殖的,且100%发荧光的细胞孔。做好标记,定期换液(含有嘌呤霉素)。
待细胞长满后进行检测,筛选出高表达或高干扰效率的细胞株,然后进行扩大培养冻存或者进行后续实验。
注意:
(1)由于第一种方法细胞接种量少,所以可以选择一个孔多加些细胞,这样观察时方便用这个孔来进行聚焦;
(2)接种96孔板时,可以不用加嘌呤霉素,待细胞生长稳定后再换液,补加嘌呤霉素;
(3)增大筛选的总量,是为了能获得最佳效果的单克隆稳定细胞株。
王老师您好,我是在读博士,最近计划给悬浮细胞转染慢病毒,不知道您有什么好的推荐吗?期待您的建议。
这个悬浮细胞我没有做过,给不了什么建议,讲道理应该差不多的
病毒感染48h后,用嘌呤霉素筛选时不到两天对照组和实验组的细胞死完,空载的细胞反而长得很好