吸入式气管滴注法的建立
晋乐飞1) ,吴卫东2) ,张 巧3) ,姚 武1) ,陈小玉3) ,李春阳3) ,徐玉宝3) ,暴 磊1) ,郭向娇4) ,冯斐斐3) #
- 郑州大学公共卫生学院劳动卫生学教研室 郑州 450001 2) 新乡医学院公共卫生学院劳动卫生学教研室 新乡 453000 3)
郑州大学公共卫生学院毒理学教研室 郑州 450001 4) 郑州大学公共卫生学院流行病学教研室 郑州 450001
#通信作者,女,1983 年 4 月生,博士,研究方向: 环境污染物引起的肺部损伤,E-mail: feifeifeng@ zzu. edu. cn
关键词 气管滴注; 插管; 呼吸道; 吸入
摘要
目的: 建立一种廉价、高效的呼吸道给药或染毒方法。方法: 24 只雄性 BALB/ c 小鼠随机平均分为两组,分别进行鼻腔滴注和吸入式气管滴注。24 只雄性 SD 大鼠随机平均分为两组,分别给予非暴露式气管滴注和吸入式气管滴注。小鼠每只滴注 50 μL 生理盐水,大鼠每只滴注 100 μL 生理盐水; 每组中取 1 只动物按相应方法滴注用生理盐水配制的含体积分数 50% 的蓝墨水,解剖观察肺部形态,评价滴注效果; 记录操作时间( 从麻醉结束至滴注完成) 和成功率。结果: 小鼠鼻腔滴注的操作时间为( 92. 6 ± 5. 4) s,吸入式气管滴注操作时间为( 25. 2 ± 4. 0) s; 大鼠非暴露式气管滴注操作时间为( 102. 6 ± 6. 5) s,吸入式气管滴注操作时间为( 39. 9 ± 3. 3) s; 吸入式气管滴注操作时间均明显较短( t = 35. 042、29. 849,P < 0. 001) 。吸入式气管滴注组小鼠和非暴露式气管滴注组大鼠的肺组织散在分布蓝色印迹,而鼻腔滴注组小鼠的肺部着色不明显; 鼻腔滴注和吸入式气管滴注的成功率为
100% ,而非暴露式气管滴注的成功率为 83. 7% 。结论: 吸入式气管滴注兼具廉价、快捷、无创、高效的优点,可广泛应用于呼吸道给药或染毒实验以及疾病模型的建立。
呼吸道暴露是职业医学、环境医学及毒理学等研究领域常用的一个重要暴露途径,呼吸道染毒、呼吸道给药已经成为动物实验不可或缺的手段[1]。气管插管是经气管给药或染毒的主要实验方法。以往的暴露式气管滴注需要切开大鼠颈部的皮肤和肌肉以暴露气管,再把微样进样器插入气管,故实验的精确性得到了保证,但是尖头的微样进样器容易引起大鼠呼吸道损伤。非暴露式气管滴注是采用磨钝的静脉留置针或穿刺针进行插管,虽然具有无创性的优点,但因为这些插管针往往和普通注射器匹配, 而普通注射器的精确度却不如微样进样器[2-4],且非 暴露式气管滴注方法难以兼顾无创性和精确性。研究[5]显示,鼻腔滴注可以达到呼吸道给药或染毒的目的,但尚没有相关的研究对其进行评价。作者通过对以往鼻腔滴注和非暴露式气管滴注方法的总结,主要介绍一种新的呼吸道给药或染毒方法———吸入式气管滴注法,为今后的相关研究提供帮助。
1. 材料与方法
1. 1 实验动物与分组 24 只 SPF 级雄性 BALB / c小鼠,体重 12 ~ 15 g; 24 只清洁级雄性 SD 大鼠,体重 200 ~ 250 g; 均购自郑州大学实验动物中心,实验动物生产许可证号: SCXK( 豫) 2010-0002; 常规饲养于郑州大学公共卫生学院动物房,实验动物使用许可证号: SYXK( 豫) 2012-0007。24 只小鼠采用随机数字表法分为两组,每组 12 只,分别采用鼻腔滴注和吸入式气管滴注; 24 只大鼠同样随机分为两组, 每组 12 只,分别进行非暴露式气管滴注和吸入式气管滴注。实验动物在无特定病原体环境下饲养,12 h /12 h 昼夜光照,饲料符合卫生部颁布的“医学实验动物全价营养饲料标准”。
1. 2 小鼠或大鼠吸入式气管滴注的操作方法 见图 1。具体步骤如下: ①将小鼠或大鼠放入乙醚麻醉缸内,迅速封住缸口,麻醉标准为倒下不动、呼吸 深慢似熟睡状。②用丝线挂住小鼠或大鼠上门齿,使其自然悬挂在自制塑料架上。③用移液枪吸取滴 注液,左手拿镊子,右手持移液枪。④用镊子将小鼠 或大鼠的舌头拉出,将滴注液注入口中,放下镊子, 用左手轻轻捏住小鼠或大鼠的鼻腔 5 s 左右,使其通过呼吸主动将滴注液吸入肺部,若听到湿啰音,则 说明滴注成功。
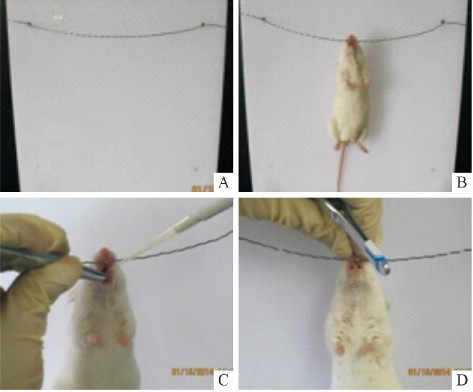
图 1 小鼠( 大鼠) 吸入式气管滴注操作方法
A ~ D: 步骤① ~ ④。
1. 3 小鼠鼻腔滴注的操作方法 将小鼠放入乙醚麻醉缸行深麻醉。左手抓取小鼠,使其头部充分暴露并倾斜 15°,右手使用移液枪吸取滴注液,逐滴滴入小鼠鼻腔,待其自动吸入并听到湿啰音,说明滴注成功。1. 4 大鼠非暴露式气管滴注的操作方法 将大鼠放入乙醚麻醉缸,麻醉不宜过深或过浅,过深容易导 致大鼠窒息而死,过浅会导致大鼠中途苏醒,影响滴 注效果甚至刺破大鼠气管。迅速将大鼠转移到自制 固定台,上门齿挂在台面上端的线绳上,使其自然下 垂。用透射灯从外部直射大鼠的脖颈处,用镊子向 上提起舌头使气管清晰可见。将打磨过的 12 号穿刺针套上注射器缓缓插入气管,若听到呼吸音增粗, 说明插入成功,慢慢把滴注液注入气管,此时会听到 湿啰音。拔出针头时会有气泡自气管往外冒,进一步证实滴注成功。
1. 5 滴注效果分析 滴注液为医用生理盐水,小鼠和大鼠每只分别滴注 50 和 100 μL,最后 1 只滴注液改为用生理盐水配制成的含体积分数 50% 的蓝墨水。然后运用 CO2 吸入法窒息处死动物,解剖观察肺部颜色,判断滴注效果。操作时间以麻醉结束至滴注完成为准。测试过程中以听到湿啰音并能恢 复到正常状态为滴注成功标准。
1. 6 统计学处理 应用 SPSS 12. 0 进行统计分析,两种滴注方法组操作时间的比较采用两独立样本 t 检验,检验水准 α = 0. 05。
2. 结果
2. 1 小鼠吸入式气管滴注和鼻腔滴注法滴注效果的比较 吸入式气管滴注组操作时间( 25. 2 ± 4. 0)
s,而鼻腔滴注组为( 92. 6 ± 5. 4) s,吸入式气管滴注组操作时间比鼻腔滴注组短( t = 35. 042,P < 0. 001) 。两组小鼠双侧肺部均呈现蓝色印迹( 图
-
- ,其中,吸入式气管滴注组小鼠双侧肺部着色更明显,说明滴注效果更好。在滴注过程中,两组小鼠 均无死亡,测试完成后,小鼠均能较快地恢复至正常 状态,小鼠的饮食和其他活动无不良改变,成功率均 为 100% 。
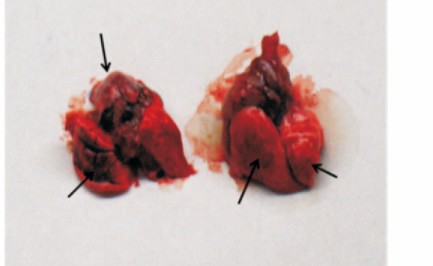
图 2 鼻腔滴注和吸入式气管滴注组小鼠肺部形态
左: 吸入式气管滴注组; 右: 鼻腔滴注组; 箭头指示着色部位。
2. 2 大鼠吸入式气管滴注和非暴露式气管滴注法滴注效果的比较 吸入式气管滴注组操作时间为( 39. 9 ± 3. 3) s,而非暴露式气管滴注组操作时间为 ( 102. 6 ± 6. 5) s,吸入式气管滴注组操作时间比非暴露式气管滴注组短( t = 29. 849,P < 0. 001 ) 。两组大鼠双侧肺部均散在分布蓝色印迹,说明两种方法的滴注效果均良好( 图 3) 。吸入式气管滴注组大鼠能够较快恢复到正常状态,成功率为 100% 。非暴露式气管滴注组大鼠恢复较慢,死亡 2 只,成功率为 83. 7% 。
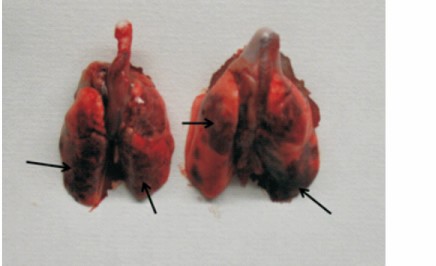
图 3 非暴露式气管滴注和吸入式气管滴注组大鼠肺部形态左: 吸入式气管滴注组; 右: 非暴露式气管滴注组; 箭头指示着色部位。
3. 讨论
目前,国内外学者在呼吸道给药或染毒方面尚 没有提出统一的实验操作方案,主要方案包括鼻腔 滴注、非暴露式气管滴注及其改进方法。有学者[5]运用鼻腔滴注的方法成功建立了小鼠肺炎链球菌性脑 膜炎模型,但由于操作时需要逐滴进行滴注,所以操 作比较耗时; 另外,滴注液也很可能经口腔到达胃部。非暴露式气管滴注虽然可弥补以往暴露式气管滴 注法有创性的不足,但插管操作很容易增加动物的 痛苦和不适,由于小鼠气管生理结构脆弱、狭窄,因此,非暴露式气管滴注法应用于小鼠会更加困难与 复杂,滴注的精确性和成功率降低[2,6]。近年来,国 内外学者对非暴露式气管滴注法进行了不断的改进 。贾晓峰等[1]建立了透射灯下经口直视气管滴注 法,成功完成了 162 次小鼠插管、滴注操作,每只动物耗时为 30 ~ 60 s( 连续 28 次滴注) ; 但运用普通注射器进行滴注其精确度远不如移液枪,并且插管操 作同样会增加小鼠的痛苦与不适。Spoelstra 等[7]运用喉镜、自制塑料支架和吸入麻醉设备建立了一套快 速插管的气管滴注法: 喉镜的使用能够精确定位气管的位置,大大保证了滴注的成功率; 麻醉剂采用异氟醚,毒性比较低,安全性好,较低剂量即可达到预 期麻醉效果[8]; 但是,该方法对操作要求比较高,其他研究者难以快速掌握。另外,该方法操作比较复杂 ,耗费时间长,整套设备费用昂贵。
作者建立了一种快速吸入式气管滴注法。该研究结果显示,吸入式气管滴注操作时间较非暴露式气管滴注和鼻腔滴注明显缩短,成功率达到 100% , 而非暴露式气管滴注的成功率为 83. 7% 。通过与其他呼吸道给药或染毒方法的对比,可以看出吸入式气管滴注法具有以下优点: ①所需器材简易,容易
获得与制备,经济合理。②不需要插管,操作简单, 容易掌握、推广。③动物自然悬挂,减少了动物的痛 苦与不适。④采用吸入麻醉法,耗费时间短,并且容 易调节麻醉深度和较快终止麻醉。滴注后,小鼠很 快苏醒,不影响正常的生理活动[9]。⑤ 滴注效果好,成功率高。
作者总结了该方法的操作过程,有以下几点启 示: ①麻醉时一定要密切观察动物的运动和呼吸状态,防止麻醉过深或过浅。②麻醉前做好滴注准备, 使麻醉和滴注操作做到无缝衔接,防止动物在气管滴 注时苏醒。③事先准备蘸有乙醚的棉花团,如果动物滴注时苏醒,可以将棉花团靠近其鼻孔,使其重新进 入麻醉状态。④轻柔拉动小鼠或大鼠的舌头,防止用力不当造成动物受伤。⑤闻及湿啰音是滴注成功的标志。应用该方法时应注意: 乙醚麻醉剂有较低的毒性,被动物吸入后易引起呼吸道分泌物增多,不宜用 于哮喘动物模型的建立[9]。若要构建小鼠或大鼠哮 喘模型,可选用异氟醚等毒性较低的麻醉剂。
综上所述,吸入式气管滴注法具有廉价、快捷、无创、高效等诸多优点,可以广泛应用于呼吸道给药或染毒实验以及各种疾病模型的建立。
参考文献
[1] 贾晓峰,郭新彪. 改进型快速小鼠气管滴注法———透射灯下经口直视滴注法研究[J]. 环境与健康杂志,2012,29( 3) : 217
[2] 彭康琳,周玉庆,周正适. 剂量精确的大鼠无创气管滴注方法[J]. 中国比较医学杂志,2013,23( 9) : 61
[3] Osier M,Oberdrster G. Intratracheal inhalation vs intratra- cheal instillation: differences in particle effects[J]. Fun- dam Appl Toxicol,1997,40( 2) : 220
[4] Lipka J,Semmler-Behnke M,Sperling RA,et al. Biodistri- bution of PEG-modified gold nanoparticles following intra- tracheal instillation and intravenous injection[J]. Biomate- rials,2010,31( 25) : 6574
[5] 胥文春,单幼兰,李南,等. 鼻腔滴注法建立小鼠肺炎链球菌性脑膜炎模型[J]. 中国病原生物学杂志,2008,3 ( 9) : 641
[6] 苗雨丹,董春玲,刘玲,等. 暴露式与非暴露式气管滴注方法建立小鼠急性肺损伤模型及其效果比较[J]. 吉林大学学报: 医学版,2012,38( 3) : 414
[7] Spoelstra EN,Ince C,Koeman A,et al. A novel and simple method for endotracheal intubation of mice[J]. Lab Anim, 2007,41( 1) : 128
[8] 邓小明,朱科明. 常用实验动物麻醉[M]. 上海: 第二军医大学出版社,2001.
[9] 王元占,杨培梁,刘秋菊,等. 常用实验动物的麻醉[J].中国比较医学杂志,2004,14( 4) : 245
老师,您好,请问气管滴注是位于声门口上方滴注即可,还是要将吸头插入声门。若是前者,可以保证液体完全吸入肺中吗?您是每天给药吗?每天给药会对小鼠有很大影响吗?