众所周知,癌细胞几乎肆虐横行在人体的每一个部位,从大脑到各个器官,从表皮到骨骼,我们曾经在进化中得到的、在生物界引以为豪的人体,在癌细胞肆虐下往往显得那么脆弱,有时似乎变得不堪一击。
癌细胞并非入侵的外族,它们与组成人体各个器官的正常细胞同文同种,但不同的是癌细胞基因结构和功能的变化赋予了它们十种特殊“器物”,从而使得它们能够在人体内纵横捭阖,所向披靡。
癌细胞有十大特征,这十个特征分别是:
- 自给自足生长信号(Self-Sufficiency in Growth Signals)
- 抗生长信号的不敏感(Insensitivity to Antigrowth Signals)
- 抵抗细胞死亡(Resisting Cell Death)
- 潜力无限的复制能力(Limitless Replicative Potential)
- 持续的血管生成(Sustained Angiogenesis)
- 组织浸润和转移(Tissue Invasion and Metastasis)
- 避免免疫摧毁(Avoiding Immune Destruction)
- 促进肿瘤的炎症(Tumor Promotion Inflammation)
- 细胞能量异常(Deregulating Cellular Energetics)
- 基因组不稳定和突变(Genome Instability and Mutation)。
这十个肿瘤细胞区别于正常细胞的特征是治疗肿瘤的靶点,是生物靶向治疗的基础。
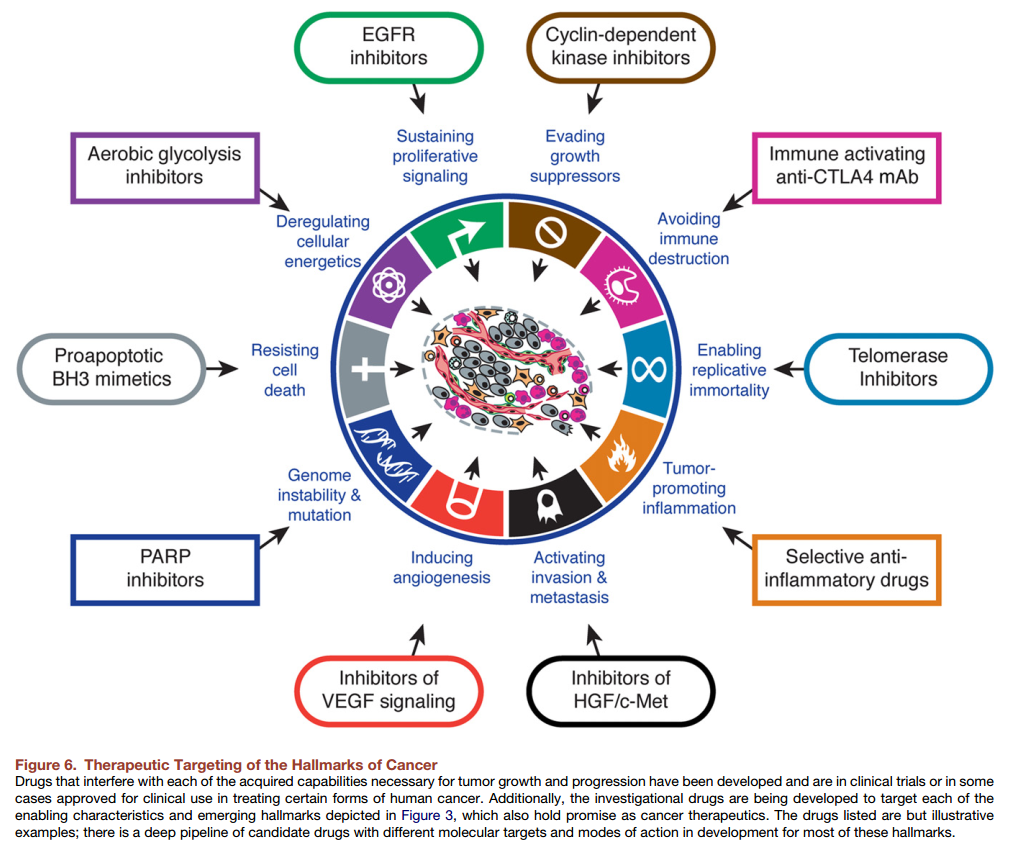
其一:生长信号的自给自足
在人体这个迄今为止最为复杂的系统中,倘若一个细胞想要改变其现有状态(如从静止到生长分化状态的改变),必须接收到一系列相关指令,这一过程才能进行,就像军队中的令行禁止一样。就这样,数以万亿计的细胞各司其职,在和谐统一的秩序中维系着人体的健康。到目前为止,科学家在正常细胞中还没有发现一例例外。
这些改变细胞状态的指令,生物学上称之为信号分子,它们多是外源的,即由另一类细胞产生,这也是人体保持自我平衡的重要机制。信号分子通过与靶细胞上相应指令接收器(受体)相结合,细胞状态改变这一过程得以实施。
在这方面,癌细胞是截然不同的,它们通过种种“奇巧淫技”把自己对外源生长信号的依赖降到了最低限度。首先癌细胞们获得自己发号施令的能力,也就是说它们可以自行其是的合成生长分化所需的生长信号,无需依赖外源性信号。比如科学家们发现在神经胶母细胞瘤和恶性肉瘤中的癌细胞就分别获得了合成PDGF(血小板源生长因子)和TGFα(肿瘤生长因子α)的能力。其次癌细胞还会大量表达其表面的信号接收器,这样就可以富集周围微环境中的生长信号从而进入生长分化状态(注:正常情况下,未经富集浓度的生长信号不足以触发生长分化)。此外癌细胞还会改造它周围的一些正常细胞成为生长信号的生产工厂供其使用,并招募一些帮凶细胞,如成纤维细胞和内皮细胞来帮助它们生长分化。
其二:对抑制生长信号不敏感
平衡似乎是人体系统中最重要的关键词。人体内除了有生长信号外,还存在着生长抑制信号。在细胞分裂的不同阶段,都有一些分子如同看家护院的“爱犬”一般时刻检测这些细胞的“身体状况”和周边环境,根据情况来决定细胞的未来的命运:或是继续生长分化,或是仍然处于静止期,抑或丧失生长分化能力进入有丝分裂的后期。这样正常细胞才能保持动态平衡的状态,进行有序的生长分化。对于癌细胞来说,如果想要扩大自己的地盘,不断地生长分化,必须逃避这些“爱犬”分子的监控。他们主要策略就是通过基因突变使得这些“爱犬”分子失去活性,从而实现对抑制生长信号不敏感的目的。
其三:规避细胞凋亡
逃避细胞凋亡几乎是所有类型的癌细胞都具有的能力。负责细胞凋亡的信号分子大体上可以分为两类:一类如同上文所述的“爱犬”分子,如一种名叫p53的蛋白就是其中最重要的成员之一;另一类则负责执行细胞凋亡。前者监控细胞内外环境,一旦发现不正常情况足以触发细胞凋亡,即指挥后者执行。目前科学研究证实,DNA损伤,信号分子的失衡以及机体缺氧都有可能触发细胞凋亡。
细胞凋亡是人体防癌抑癌的主要屏障。在“爱犬”分子眼中,癌细胞就是一种状态不正常的细胞,而癌细胞逃避细胞凋亡的主要方法是通过基因突变使p53蛋白失活。统计显示大约超过50%的人类癌症中发现p53蛋白的失活。
其四:具有无限的复制潜力
在细胞体外培养实验中,人们观察到,大多数正常细胞仅有60次左右的分裂能力。科学家已经证实,细胞的分裂能力与染色体末端的一段数千个碱基的序列有关。这段序列成为端粒,每经一个分裂周期,这段序列就会减少50~100个碱基,随着分裂次数的渐多,端粒变得越来越短,后果就是其无法再保护染色体的末端,染色体也就无法顺利复制,进而导致细胞的衰老死亡。
研究结果表明,所有类型的癌细胞都有维持端粒的能力。这种能力主要是通过过量表达端粒酶实现的。端粒酶主要功能是为端粒末端添加所需碱基,以保证端粒不会因复制而缩短。
其五:持续的新生血管形成
对细胞来说,血管就是最重要的“粮道”。这个“粮道”对于细胞正常生长并良好地行使其功能是如此重要,以至于一个细胞与其最近的毛细血管的距离不能超过100微米。
通常情况下,在组织形成和器官发生这些生理过程中,血管生成是受到精细调控的,而且这种情况下的血管形成也是暂时的,当上述生理过程结束后,血管生成即会停止。促进和抑制血管生成的信号分子通常处于“势均力敌”的平衡状态。
癌细胞获得持续的新生血管形成能力就是通过打破这种平衡状态开始的。科学家们在许多类型的肿瘤当中发现,一些促进血管形成的信号分子如VEGF(血管内皮生长因子)和FGF(成纤维细胞生长因子)的表达水平都远高于相应的正常组织对照,而一些起抑制作用的信号分子如thrombospondin-1或β-interferon的表达则下降。
其六:侵袭和转移
人体中的正常细胞除了成熟的血细胞外,大多数需要粘附在特定的胞外基质上才能存活并正常行使功能,比如上皮细胞及内皮细胞,一旦脱离细胞的胞外基质则会发生细胞凋亡。将这些细胞粘附在胞外基质或互相粘附在一起的分子称为细胞粘附分子,它们如同“锚”把船固定在港口一样发挥着锚定的作用。
E-钙粘素是目前研究最深入的细胞粘附分子之一。它在上皮细胞中广泛表达,而在大多数上皮细胞癌中则发现活性的丧失,而丧失的方式有多种多样,如基因水平上突变导致的失活及蛋白水平上活性区域被降解导致的失活等。科学家们认为E-钙粘素在上皮细胞癌中发挥着广泛的抑制癌细胞侵袭和转移的作用。它的活性的丧失标志着癌细胞在获得第六种武器的道路上迈出了重要的一步。
其七:免疫逃避
无论是固有免疫还是适应性免疫系统在肿瘤清除中都起着重要的作用。而实体肿瘤却都具有不同的逃逸人体免疫系统监视的功能,从而确保它们不被免疫细胞如T细胞,B细胞,巨噬细胞和自然杀伤细胞的杀伤和清除。在结肠癌和卵巢癌患者中,那些体内含有大量CTLs和NK杀伤细胞的病人状况要比缺少这些免疫细胞的病人好得多。而在那些具有高度免疫原性的癌细胞中,它们通常会通过分泌TGF-β或其它免疫抑制因子来瘫痪人体的免疫系统。
其八:调控细胞代谢
即便在有氧气的条件下,癌细胞也会通过调控,使其能量主要来源于无氧糖酵解的代谢方式,这被称为“有氧糖酵解”。目前已经有研究证实了在神经胶质瘤和其它种类的癌细胞中,异柠檬酸盐脱氢酶功能上的突变也许和细胞能量代谢方式的改变有关,它能提高细胞中氧化物的含量从而影响基因组的稳定性,还可以稳定细胞中的HIF-1转录因子以提高癌细胞的血管生成和浸润能力。
其九:基因不稳定性和易突变
肿瘤复杂的发生过程可以归根于癌细胞基因的不断突变。在需要大量基因突变来诱导肿瘤发生时,癌细胞常常会提高其对可诱导基因突变物质的敏感性,从而加快它们基因突变的速度。在该过程中,由于某些稳定和保护DNA的基因发生突变,会显著提高癌症的发生几率。尽管在不同类型的肿瘤中基因突变的种类不同,但均可以发现大量稳定和修复基因组DNA的功能缺失。提示我们肿瘤细胞的一大重要特征就是固有的基因组不稳定性。
其十:引发炎症反应
在过去数十年中,大量的研究证实了炎症反应(注:主要由固有免疫细胞引起)和癌症发病机理之间的关系:炎症反应可为肿瘤微环境提供各种生物激活分子,例如包括生长因子(可维持癌细胞的增殖信号)、生存因子(可抑制细胞死亡)、促血管生成因子和细胞外基质修饰酶(可利于血管生长,癌细胞浸润和转移)、以及其它诱导信号(可激活EMT和癌细胞的其它一些特征)。此外,炎性细胞还会分泌一些化学物质,其中ROS可以加快临近癌细胞的基因突变,加速它们的恶化过程。
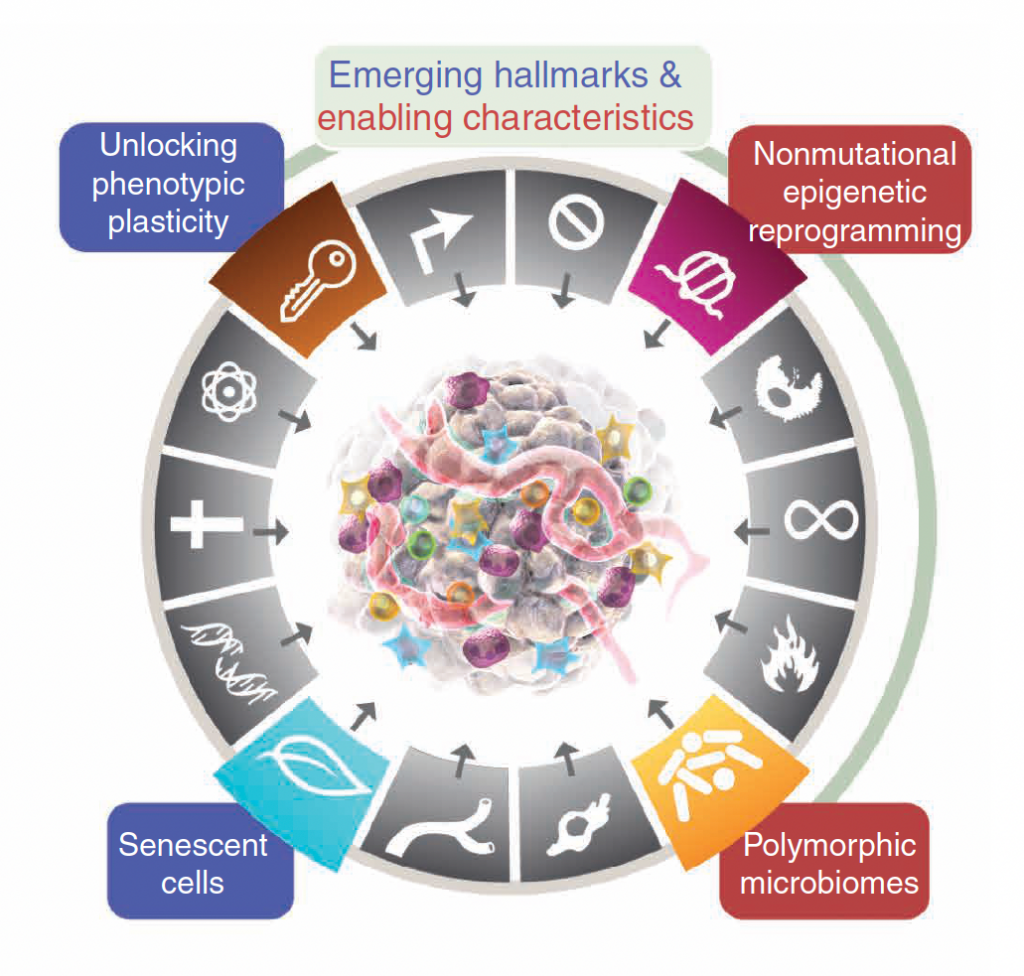
第三版(2022):又增加了4个特征
在既往10个特征的基础上,再一次增加了4个特征,分别是:
1、解锁表型可塑性(Unlocking phenotypic plasticity),而表型可塑性可以破坏细胞分化。
2、衰老细胞(Senescent cells),细胞衰老被认为是维持组织稳态的一种保护机制,然而越来越多的证据提示,在某些情况下,衰老细胞可以各种方式促进肿瘤的发生、发展。
3、非突变表观遗传重编程(non-mutational epigenetic reprogramming),表观遗传即DNA序列没有发生变化,但基因功能发生了可遗传的变化。
4、多态微生物组(Polymorphic microbiomes),存在于结肠、其他黏膜及其连接器官,或肿瘤自身的微生物组。前两个特征为“新出现的特征”,后两者为“赋予的特征”。
癌症的发病机制涉及遗传学、细胞和组织生物学、病理学等,不同癌症类型对治疗的反应也各不相同。科学技术的快速发展,提供了丰富的癌症“大数据”,并将其复杂性凝练成一种逻辑科学,有助于我们更全面的了解癌症的发生、发展,也将这些知识应用到肿瘤的治疗中。
参考资料:
1、Cell. 2000; 100(1): 57-70.
2、Cell. 2011; 144(5): 646-674.
3、Cancer Discov. 2022; 12: 31-46.
现在又有4个新特征了~
谢谢啦,我学习一下 补充完整