以免疫检查点抑制剂(ICIs)为代表的免疫疗法极大地提高了恶性肿瘤治疗的临床疗效。尽管ICIs已在广泛的肿瘤类型中显示出临床活性,但仍有相当大比例的患者对ICIs治疗没有反应。ICIs介导的抗肿瘤反应取决于能够识别和杀死肿瘤细胞的T细胞的浸润程度。CD8+T细胞等免疫细胞与延长癌症患者的生存期和提高免疫治疗的有效性有关。肿瘤中缺乏T细胞可能导致对免疫治疗的抵抗。CAR-T细胞输注治疗白血病和淋巴瘤的成功也证明了T细胞在抗肿瘤免疫中的重要性。
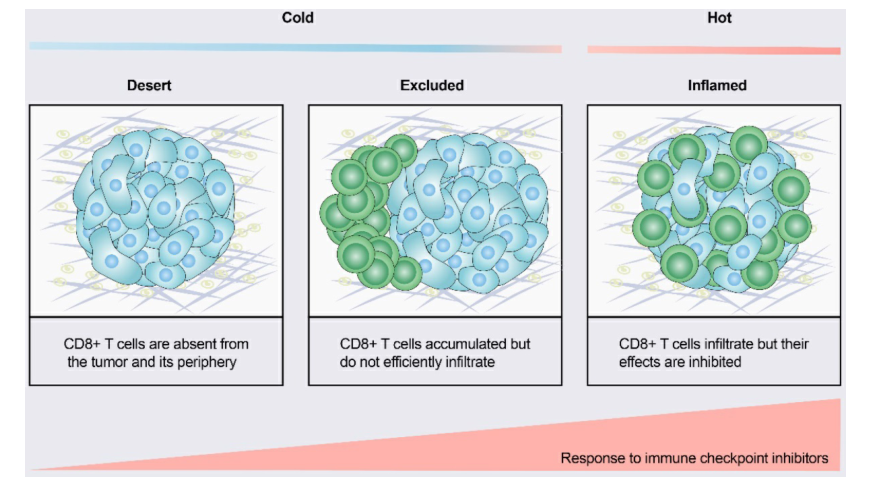
根据肿瘤微环境(TME)中细胞毒免疫细胞的空间分布,肿瘤可分为三种基本免疫表型之一:免疫炎症表型、免疫排斥表型和免疫沙漠表型(图1)。免疫性炎症性肿瘤,又称“热点肿瘤”,以T细胞高浸润、IFN-γ信号增强和高肿瘤突变负荷(TMB)为特征。具有炎症表型的肿瘤往往对ICIs更敏感。免疫排斥肿瘤和免疫沙漠肿瘤被称为“冷肿瘤”。在免疫排斥的肿瘤中,CD8+T细胞仅位于侵袭边缘,不能有效浸润肿瘤。在免疫沙漠肿瘤中,CD8+T细胞不存在于肿瘤及其周围。除了不良的T细胞浸润外,“冷肿瘤”的特征还在于低TMB,低MHC I类表达和低PD-L1表达。免疫抑制细胞群,包括肿瘤相关巨噬细胞(TAM)和T调节细胞(Tregs)和骨髓衍生抑制细胞(MDSCs),也存在于冷肿瘤中。这些特征表明,冷肿瘤缺乏先天免疫功能,或者“冷肿瘤”中存在的先天抗肿瘤免疫功能可能由于免疫细胞被排斥而无效。与炎症表型相反,冷肿瘤很少对ICIs单一疗法有反应。
驱动T细胞进入TME是一个渐进的过程(图2):肿瘤细胞死亡和抗原释放,抗原提呈细胞(APC)处理和提呈肿瘤抗原,APC和T细胞相互作用导致T细胞启动和激活。理想情况下,一旦被激活,这些肿瘤特异性T细胞就会离开淋巴结,通过血流到达肿瘤部位。T细胞的产生及其与肿瘤细胞的物理接触是抗肿瘤免疫成功的关键。一旦进入肿瘤床, CTL就能特异性识别肿瘤细胞表面的抗原肽-MHC复合物,形成免疫突触,释放穿孔素和颗粒酶或Fas/FasL途径破坏肿瘤细胞。死亡的肿瘤细胞释放额外的肿瘤抗原,从而放大T细胞的反应。
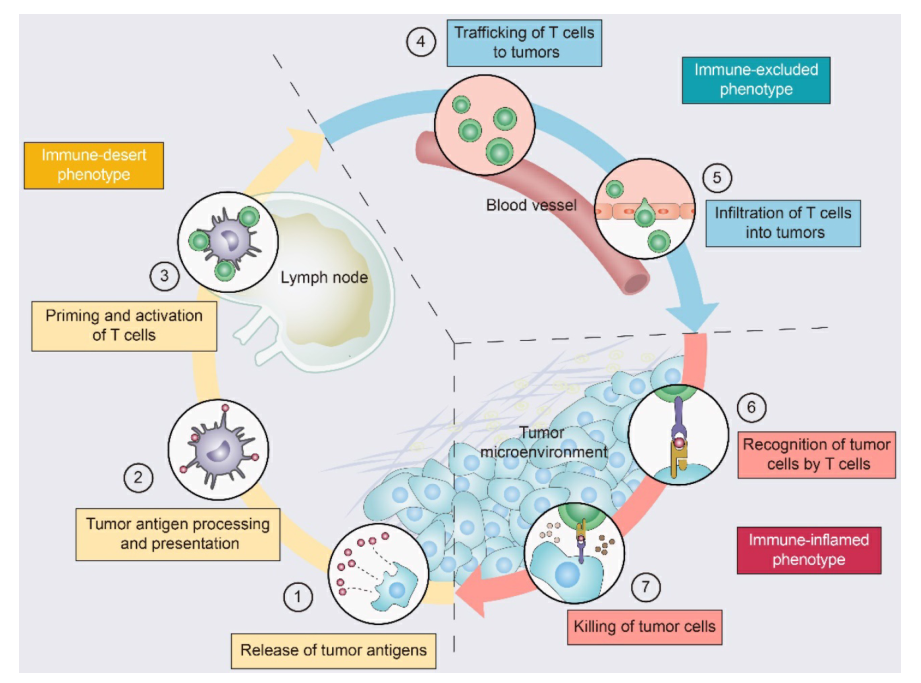 图2. 驱动T细胞进入TME的过程
图2. 驱动T细胞进入TME的过程鉴于T细胞浸润的重要性,了解T细胞归巢至肿瘤的机制是必要的。为了提高免疫疗法的临床益处,ICIs可以与将“冷肿瘤”转化为“热肿瘤”的策略相结合,这可以使这些肿瘤对ICIs疗法更敏感。本文将分两篇对T细胞浸润障碍的各种机制以及T细胞浸润肿瘤的策略进行一个简单的总结。
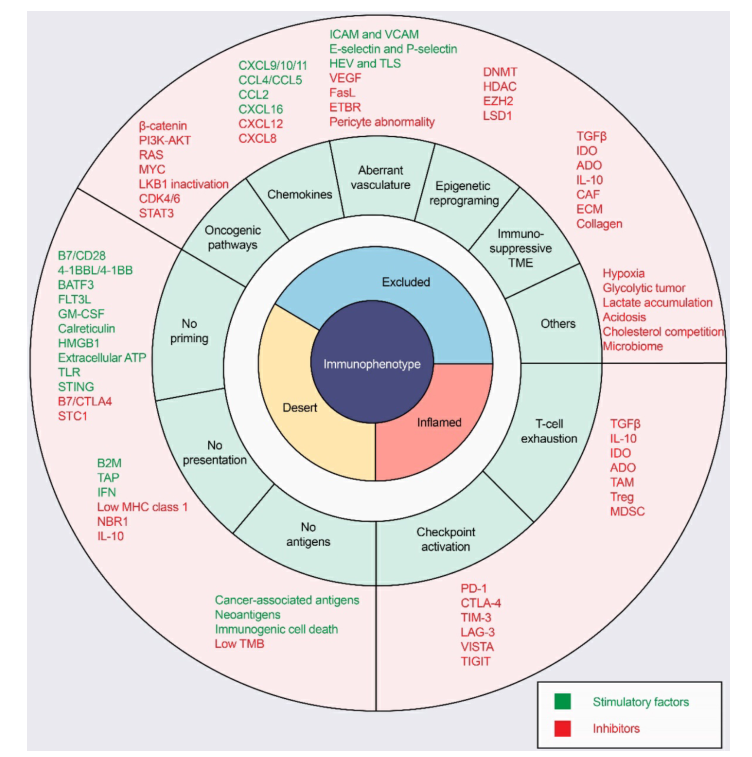
ICIs应答率在“冷肿瘤”中很低,其特点是没有T细胞浸润。在驱使T细胞进入肿瘤的过程中,有许多因素可以影响T细胞启动和T细胞归巢到肿瘤部位,导致T细胞为非炎表型以及抗肿瘤免疫失败(图3)。
01
T细胞启动缺陷

表1总结了T细胞启动缺陷的主要机制。

表1. T细胞启动缺陷的主要机制
缺乏肿瘤抗原
由于缺乏肿瘤抗原,T细胞启动障碍的最直接原因是T细胞识别不足。一般而言,靶向肿瘤抗原可分为两大类:非突变自身抗原和非同义体细胞突变产生的新抗原。自身抗原包括在肿瘤细胞中异常表达或过表达的非突变蛋白,例如肿瘤相关抗原(TAA)和癌/睾丸抗原(CTAs)。尽管自身抗原也引发肿瘤免疫应答,但免疫应答的主要靶标是新抗原,也称为肿瘤特异性抗原(TSA)。新抗原起源于癌症基因组中的体细胞突变,因而在肿瘤细胞中特异性存在。肿瘤新抗原的识别可能促进T细胞的启动和浸润,并导致长期的临床应答反应。
TMB被广泛地描述为肿瘤中非同义单核苷酸突变的总数。一般说来,TMB含量较高的肿瘤被认为携带更高的新抗原负荷,可以被T细胞识别,使它们更有可能启动免疫系统。在各种肿瘤类型中,已经报道了高TMB与ICIs反应改善之间的显著关联。TMB已被用作一种新的生物标志物来预测PD-1/PD-L1抑制剂的疗效。与ICIs疗效的重要性一致的是,高TMB与更多的免疫细胞浸润有关。
肿瘤抗原处理和提呈机制(APM)的缺陷
在识别肿瘤抗原后,APC处理抗原并在其表面上表达相应的抗原肽-MHC I类复合物。然而,APM的改变,例如MHC-I分子表达的下调或β-2-微球蛋白(B2M)的缺失,限制了抗原肽-MHC I类复合物的呈递。此外,溶酶体途径与CD8+T淋巴细胞浸润减少有关。在PDAC中,自噬相关受体NBR1诱导肿瘤细胞表面MHC-I的降解,进而影响T细胞反应。这些发现表明肿瘤抗原加工和呈递途径中的缺陷抑制T细胞启动和癌症免疫疗法的有效性。
DC-T细胞相互作用的功能障碍
树突状细胞(DC)是一类专业性APC细胞,具有获得抗原、向次级淋巴器官(如淋巴结和脾脏)迁移、启动体内免疫应答等独特能力。DC激活需要它们表面的模式识别受体(PRR)识别“危险信号”,包括病原体相关的分子模式(PAMPs)和损伤相关的分子模式(DAMP)。这种识别使DC能够在与T细胞接触时将肿瘤抗原肽-MHC-I类复合物呈递给T细胞。DC还表达共刺激信号,如B7(包括CD80和CD86),提供T细胞激活所需的二级信号。肿瘤细胞可以通过捕捉“危险信号”来介导DC吞噬功能减弱。例如,细胞内检查点stanniocalcin 1(STC1)可以捕获阻滞剂(如钙网蛋白(CRT)),从而抑制DC吞噬和T细胞激活,有助于肿瘤免疫逃逸。在黑色素瘤患者中,STC1与T细胞活性低和存活率低有关。
DC细胞一般分为两大类:以产生IFN-α为特征的浆细胞样树突状细胞(pDC)和能有效刺激T细胞增殖的常规树突状细胞(cDCs)。CDC进一步分为两个不同的子集:依赖BATF3的DC和依赖IRF4的DC。BATF3树突状细胞能够通过MHC-I途径交叉呈递肿瘤衍生抗原,从而启动T细胞。此外,BATF3树突状细胞是CXC-趋化因子配体9(CXCL9) 和CXCL10的主要来源,是将表达CXCR3的CD8+T细胞招募到肿瘤中关键趋化因子配体。在黑色素瘤中,BATF3 DC标志物(如BATF3和IRF8)、CXCL9、CXCL10和CXCL11的表达与CD8+效应T细胞表型有显著的相关性。在缺乏BATF3树突状细胞的情况下,CD8+效应T细胞不能迁移到肿瘤中,因此抗肿瘤免疫功能有缺陷。这一发现证实了BATF3树突状细胞可能是内源性T细胞启动和募集对抗肿瘤所必需的。
Fms样酪氨酸激酶3配体(FLT3L)和粒细胞巨噬细胞集落刺激因子(GM-CSF)的调节对DC的分化和募集非常重要。FLT3L是一种促进造血祖细胞从骨髓分化为DC系的生长因子。肿瘤来源的FLT3L增加了BATF3树突状细胞和CD8+T淋巴细胞在小鼠肿瘤中的浸润,并增加了引流淋巴结中的迁移性和驻留DC亚群,表明FLT3L对DC细胞具有动员作用。缺乏FLT3L或GM-CSF会导致次级淋巴器官中的DC数量减少,并减弱T细胞免疫反应。鉴于DC-T细胞串扰在T细胞启动中的重要作用,DC激活受损、DC缺乏以及共抑制信号的过度表达可导致T细胞活化受损。
02
T细胞归巢至肿瘤的缺陷

表2总结了阻止T细胞归巢到肿瘤床的机制。
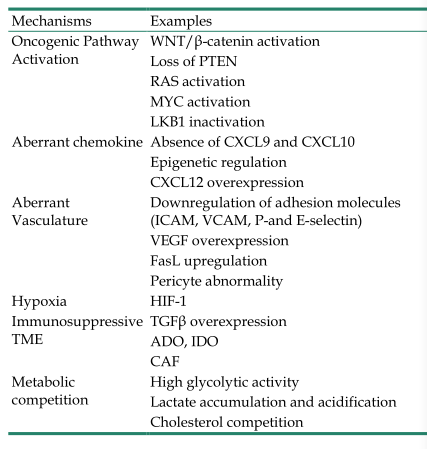
表2. 阻止T细胞归巢到肿瘤床的机制
致癌途径激活
越来越多的证据表明,肿瘤细胞致癌通路的激活与“冷肿瘤”表型和免疫治疗耐药的可能性有关。在Wnt/β-catenin阳性黑色素瘤中,CCL4的产生减少导致BATF3 DC向TME的募集减少。最终,在缺乏BATF3 DC产生的CXCL9和CXCL10的情况下,CTL不会被招募到肿瘤中。一项对人类转移性黑色素瘤样本的分析显示,CD8A的表达与β-catenin信号通路的激活呈负相关。直接注射BATF3 DC有助于恢复β-catenin阳性肿瘤的T细胞浸润,并导致肿瘤抑制。这一结果表明,Wnt/β-catenin信号的激活和缺陷的BATF3 DC介导了T细胞排斥和肿瘤细胞从免疫系统中逃逸。
PTEN的缺失激活了PI3K/AKT通路,这与黑色素瘤的非炎性T细胞表型和免疫耐受有关。已经发现PTEN表达的缺失可以减少自噬蛋白LC3的脂化,导致自噬活性降低,从而抑制T细胞启动和T细胞介导的抗肿瘤反应。PTEN缺陷型黑色素瘤中CD8+T细胞浸润较表达PTEN的黑色素瘤明显减少。TCGA数据集分析的结果表明,在低PTEN表达的黑色素瘤中,T细胞效应分子(如IFN-γ和颗粒酶B)的表达显著降低。
作为与癌症进展相关的最常见突变的基因,RAS可导致多种信号通路(如MAPK和PI3K)的激活,从而驱动肿瘤发生。另外,致癌K-RAS突变介导与TME的炎症和串扰。例如,致癌K-RAS突变通过产生抑制性细胞因子(例如IL-6和IL-8),NLRP3炎性体的活化和趋化因子(例如CCL5和CCL9)的释放诱导促肿瘤炎症。
通过MYC的致癌信号增强了肿瘤细胞上CD47和PD-L1的表达。CD47与巨噬细胞、树突状细胞等APC细胞表面的抑制性受体Sirpα结合,可阻止肿瘤细胞的吞噬,干扰抗原摄取。致癌KRAS和MYC协同诱导免疫调节。例如,在小鼠肺癌模型中,KRAS和MYC的共同激活导致CCL9和IL-23的产生。它介导间质重编程,促进血管生成,并将T、B细胞和NK细胞排除在肿瘤之外。CDK4/6和STAT3的激活与非炎症T细胞表型也相关。
综上所述,这些结果表明,致癌通路的激活不仅可以影响肿瘤细胞,而且还可以影响T细胞介导的抗肿瘤免疫。
趋化因子及其表观遗传调控
效应性T淋巴细胞上的某些趋化因子受体与相应的趋化因子之间的相互作用可能影响效应性T淋巴细胞向肿瘤部位的转运。一些趋化因子的缺乏,包括CXCL9、CXCL10、CCL4、CCL5、CXCL16、CX3CL1,已被报道导致T细胞排斥。考虑到TH1型趋化因子CXCL9和CXCL10对T细胞募集的重要性,某些肿瘤表现出低水平的CXCL9和CXCL10表达,可能解释了效应性T淋巴细胞在这些肿瘤床中浸润减少的原因。例如,BATF3树突状细胞是CXCL9和CXCL10的主要来源,缺乏BATF3树突状细胞会导致CXCL9和CXCL10的低表达。此外,肿瘤的表观遗传调节对于维持这些细胞因子的低表达水平也很重要。DNA甲基转移酶(DNMT)和ZEST同源增强子2(EZH2)可分别介导DNA甲基化和组蛋白赖氨酸甲基化,从而抑制CXCL9和CXCL10在卵巢癌中的表达。类似的结果在结肠癌中也得到了证实。除CXCL9和CXCL10外,CCL5的表达与CD8+T细胞浸润呈正相关。CCL5与CCR5结合促进CD8+T细胞的募集。然而,DNA甲基化导致CCL5表达缺失,进而导致CD8+T细胞浸润缺失。在NSCLC小鼠模型中,DNMT抑制剂和组蛋白脱乙酰化酶(HDAC)抑制剂联合使用可增加内源性逆转录病毒(ERV)的表达,进而诱导I型干扰素应答。这种联合治疗通过下调致癌MYC信号来逆转NSCLC模型的免疫耐受,导致CCL5增加,并促进T细胞向肿瘤的浸润。
一些趋化因子对T细胞向肿瘤的转运是不利的。基质细胞,特别是癌症相关成纤维细胞(CAF)是CXCL12的主要产生细胞。CAFs产生的CXCL12会将CTL误导到肿瘤外间质,并阻止CTL进入肿瘤。此外,据报道,CXCL8的高表达与肿瘤中T细胞数量的减少、中性粒细胞和单核细胞浸润的增加以及对ICIs的反应有限有关。这些结果揭示了趋化因子受体和配体相互作用对CTL归巢到肿瘤及其整合到TME中的调节作用。
异常的血管系统与缺氧
T细胞在肿瘤中的充分浸润不仅取决于合适的趋化因子的募集,而且还受肿瘤血管的控制。在CD8+T淋巴细胞向肿瘤转移的过程中,它们必须进入肿瘤循环系统,粘附血管内皮细胞,并通过血管壁迁移。CD8+T细胞在肿瘤中的募集需要血管内皮细胞黏附分子的作用,包括P-和E-选择素、细胞间黏附分子(ICAM)和血管细胞黏附分子(VCAMs)。然而,肿瘤内皮细胞上黏附分子的下调或无效聚集导致内皮细胞无能和T细胞向肿瘤部位的转运减少。内皮素与内皮细胞上内皮素B受体(ETBR)结合,减少ICAM-1的产生,从而抑制CD8+T细胞与内皮细胞的粘附。此外,由肿瘤和间质细胞产生的血管内皮生长因子(VEGF)刺激内皮细胞增殖,导致新的血管形成,通常伴随着组织灌注受损和血管通透性增加。VEGF还可以减少内皮细胞表面VCAM-1等重要分子的表达,最终阻止T细胞向TME迁移。肿瘤内皮细胞抑制T细胞迁移的另一个机制是调节免疫细胞的活性。IL-10、PGE2和VEGF可诱导肿瘤内皮细胞FasL表达上调,从而杀伤肿瘤相关T细胞,抗FasL可减弱这种杀伤作用。抑制COX和PGE2活性的乙酰水杨酸(ASA)和VEGF抗体促进了TME中CD8+T淋巴细胞的浸润,改善了预后。
此外,血管紧密连接受损和通透性增加会导致缺氧、酸中毒和坏死,从而抑制免疫效应器T细胞功能和抗肿瘤免疫。作为癌症的一个标志,缺氧是由肿瘤细胞增殖引起的氧气需求增加和血管生成导致的血液供应不足引起的。缺氧诱导因子1(HIF1)是缺氧激活的关键转录因子。缺氧通过几种方式抑制T细胞的浸润。首先,缺氧促进免疫抑制细胞向TME募集。其次,缺氧诱导的CCL28和VEGF促进血管生成并影响T细胞的运输。最后,低氧和TGFβ可上调肿瘤组织中CD39和CD73的表达。CD39和CD73催化ATP顺序转化为胞外腺苷(ADO)。腺苷与腺苷A2A受体(A2AR)结合,抑制IL-2等细胞因子的产生,进而抑制T细胞的发育和增殖。在小鼠黑色素瘤模型中,A2AR的抑制增加了T淋巴细胞的浸润,并导致了肿瘤控制的改善,这表明ADO信号通路在促进T细胞排斥方面有潜在的作用。此外,ADO还可以通过抑制NK细胞和DC的效应功能,促进MDSCs和Treg细胞的募集和极化,从而削弱抗肿瘤免疫。
TME:免疫抑制细胞和因子
肿瘤部位的免疫抑制微环境,包括致密的间质和免疫抑制细胞及因子,可以阻止T细胞在“冷肿瘤”中的启动和浸润。TGFβ是一种强有力的免疫抑制细胞因子,能促进免疫逃逸并阻止TH1效应表型的获得。TGFβ的主要生产者是TME中丰富的CAF。CAF增加TGFβ的产生与肿瘤中的T细胞排斥和对PD1/PDL1单抗反应差有关。TGFβ通过抑制IL-2的产生来限制CD4+T淋巴细胞的增殖,并诱导naive的CD4+T淋巴细胞转化为Treg。TGFβ也会对DC分化和抗原提呈功能产生负面影响,这会干扰T细胞的启动。综上所述,TGFβ通过影响T细胞分化和功能,阻止T细胞向肿瘤浸润,从而阻碍抗肿瘤免疫。
色氨酸代谢经常在多种癌症中失调,并与免疫耐受有关。肿瘤细胞中的吲哚胺2,3-双加氧酶(IDO)能将必需的氨基酸色氨酸转化为犬尿氨酸,从而阻断T淋巴细胞的启动,促进Tregs的发育。IDO还招募和激活MDSCs,并抑制肿瘤特异性T淋巴细胞在肿瘤中的积累。然而,在III期临床ECHO-301研究中,IDO抑制剂epacadostat与Keytruda联合应用的失败表明靶向IDO的药物的有效性需要进一步考虑。
CAF是肿瘤间质中的关键细胞成分,可以促进肿瘤生长。CAF主要位于肿瘤的浸润边缘,通过合成和重塑细胞外基质(ECM)和产生细胞因子来调节肿瘤转移和影响血管生成,并将肿瘤边缘转化为免疫“冷”区。CAF通过几种机制导致免疫抑制和T细胞排斥。首先,CAF产生细胞外基质,形成物理屏障,防止T细胞渗入肿瘤区域。其次,CAFs产生的CXCL12已被证明能抑制胰腺癌模型肿瘤内的T淋巴细胞浸润。第三,CAF还可以通过产生TGFβ和IL-6来降低T细胞反应并发挥免疫抑制作用。对CAF重新编程是实现TME“正常化”的有效策略。这一策略降低了细胞外基质水平,减轻了血管压力,增加了T细胞的穿透程度,从而改善了癌症治疗。
此外,TAMs通过调节ECM和介导CCL2和CCL5的信号,将T细胞排除在肿瘤之外。TAMs通过产生VEGF和基质金属蛋白酶-9(MMP9)促进异常血管生成,从而影响T细胞的募集。细胞因子集落刺激因子-1(CSF-1)和CSF-1R的相互作用能够促进髓系细胞向免疫抑制的M2巨噬细胞表型分化。用CSF1R抑制剂靶向TAMs可以减少TAMs的数量,增加CD8+T细胞等效应淋巴细胞的浸润。
肿瘤细胞的典型特征是高葡萄糖摄取率和活跃的糖酵解,即使在氧气存在的情况下也是如此。这种现象被称为“沃伯格效应”。在这个过程中,葡萄糖被迅速消耗,TME中乳酸的丰度增加。葡萄糖缺乏、富含乳酸的TME对浸润的T细胞施加代谢压力,导致局部免疫抑制和ICI耐受。TME中的缺糖代谢介导T细胞的低反应性,抑制mTOR的激活,降低糖酵解能力和INFγ的产生。此外,糖酵解活性和T细胞浸润在多种肿瘤中呈负相关。与此一致的是,肾细胞癌中葡萄糖转运蛋白1(GLUT-1)的高表达与CD8+T细胞的低浸润有关。这些结果表明糖酵解性肿瘤与非炎症T细胞表型有关。除了肿瘤细胞外,基质细胞,如CAF和TAM,也可以促进乳酸在TME的积累。TME的乳酸积累和酸化抑制了抗肿瘤免疫。乳酸诱导的酸中毒损害了单核细胞向树突状细胞的分化,抑制了树突状细胞的抗原提呈功能,进而抑制了T细胞的激活。此外,乳酸抑制CTL的趋化和抗肿瘤活性,促进肿瘤免疫逃逸。抑制乳酸的产生或恢复TME的生理pH可逆转乳酸对抗肿瘤免疫的抑制作用。例如,用碳酸氢钠中和肿瘤酸性,结合ICIs或过继细胞疗法(ACT),可以有效地促进T细胞浸润,改善各种小鼠肿瘤模型的抗肿瘤反应。
除了葡萄糖,肿瘤和免疫细胞之间的代谢竞争还包括氨基酸和脂肪酸。例如,肿瘤中胆固醇的高速酯化抑制了T细胞受体(TCR)的聚集和免疫突触的形成。胆固醇酯化关键酶ACAT1抑制剂avasimibe能促进CD8+T细胞增殖,具有良好的抗肿瘤作用。新的研究还证实,抑制调节胆固醇代谢的关键蛋白PCSK9可以上调肿瘤细胞表面的MHC-I水平,增加CTL在肿瘤内的浸润,并与抗PD1抗体协同抑制肿瘤生长。考虑到肿瘤代谢和免疫细胞代谢之间的相互作用,引导代谢途径降低T细胞的代谢应激是提高免疫治疗效果的一种有前途的策略。
参考文献
1.Turning cold tumors into hot tumors by improving T-cell infiltration(主要文献).
2.Primary, adaptive, and acquired resistance to cancer immunotherapy.
3.Approaches to treat immune hot, altered and cold tumours with combination immunotherapies.