要点:
HDR(Homology Dependent Repair)同源DNA序列介导的DNA修复机制的“刚需”
基因组是细胞赖以生存的“蓝图”,细胞信号转导通路是从基因组获取“指令”的。细胞在“中心法则”指导下转录翻译功能蛋白质并发挥细胞功能或进行个体组织与器官有序的发育。所以,基因组DNA序列在生物遗传,具体到“DNA复制”这个机制环节是需要绝对程度的“保真性”。
DSB/DSBs(Double-strand DNA breaks):“双链DNA断裂现象”。该现象是对细胞是极其有害的;在多种细胞中,一条未经修复的DSBs对细胞的伤害是致命的。
导致“双链DNA断裂现象”DSBs的原因:
1. 辐射原因:X-ray(X射线)、γ-ray(伽玛射线)辐射会直接导致DNA双链断裂;UV(紫外线)可直接导致DNA单链断裂,单链DNA的断裂积累再形成“双链DNA断裂现象“。
2. 化学原因:一些核苷类诱变剂可以破坏DNA分子结构或影响核苷合成代谢过程,从而产生“双链DNA断裂现象”。
3. 通路原因:细胞信号转导通路的异常或干扰,导致DNA复制叉停滞;DNA 复制过程受到干扰从而产生“双链DNA断裂现象”。
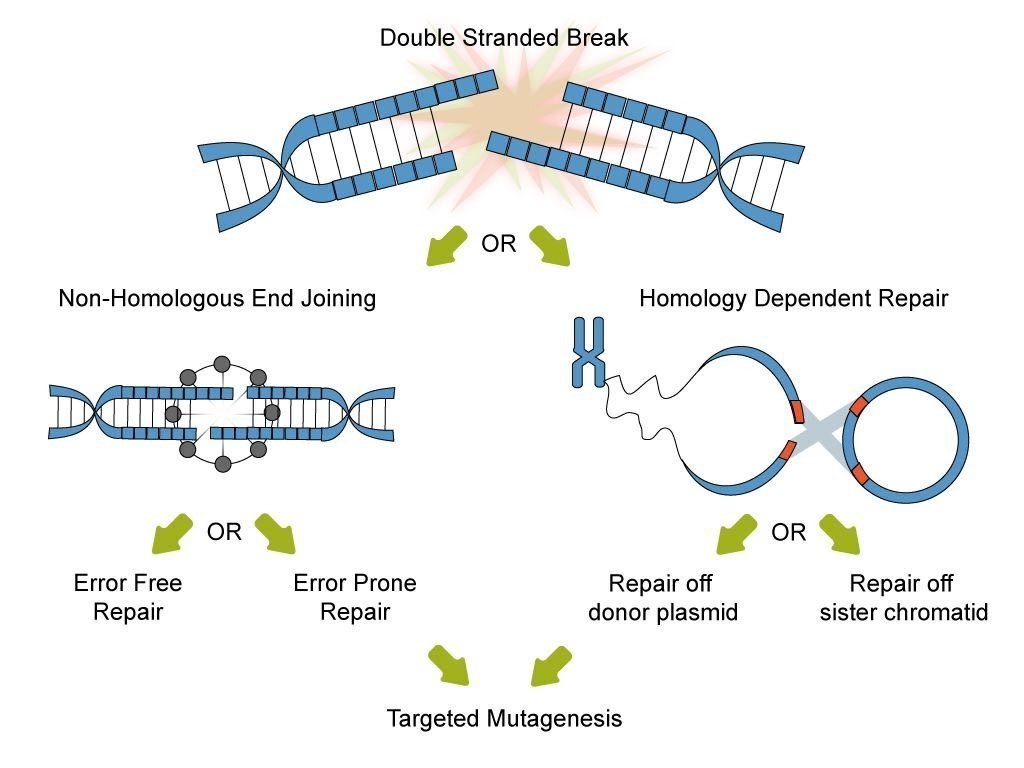
针对DSBs结果,细胞主要启动两种“DNA修复”细胞信号转导通路:HDR与NHEJ。
1,HDR同源重组修复 (Homology directed repair ): 是在两个相似或相同的DNA分子核苷酸序列之间交换的一种遗传重组,并且在断端不会出现核苷酸缺失或增加,能精确地修复DNA双链的断裂。是通过同源重组的方法修复DNA双链损伤的一种重要机制。
在真核细胞中,主要发生在细胞的S期。
第一步:识别DSB,招募RecBCD复合物进行DSB断端处理,断端从5′-3’降解核苷酸,形成3’端单链DNA(ssDNA)。
第二步:3’端单链DNA(ssDNA)调整和侵入另外一条同源链从而进行后续的DNA分子交换,形成“HJ模型”(Holliday Junction)。(RecA)
第三步:DNA碱基互补配对,DNA合成及延伸。(RecA和DNA聚合酶)
第四步:“HJ模型”(Holliday Junction)交叉支点的迁移和切断。
第五步:两个双链DNA解离,DNA连接酶连接DNA断端,得到两个独立完整的双链DNA。
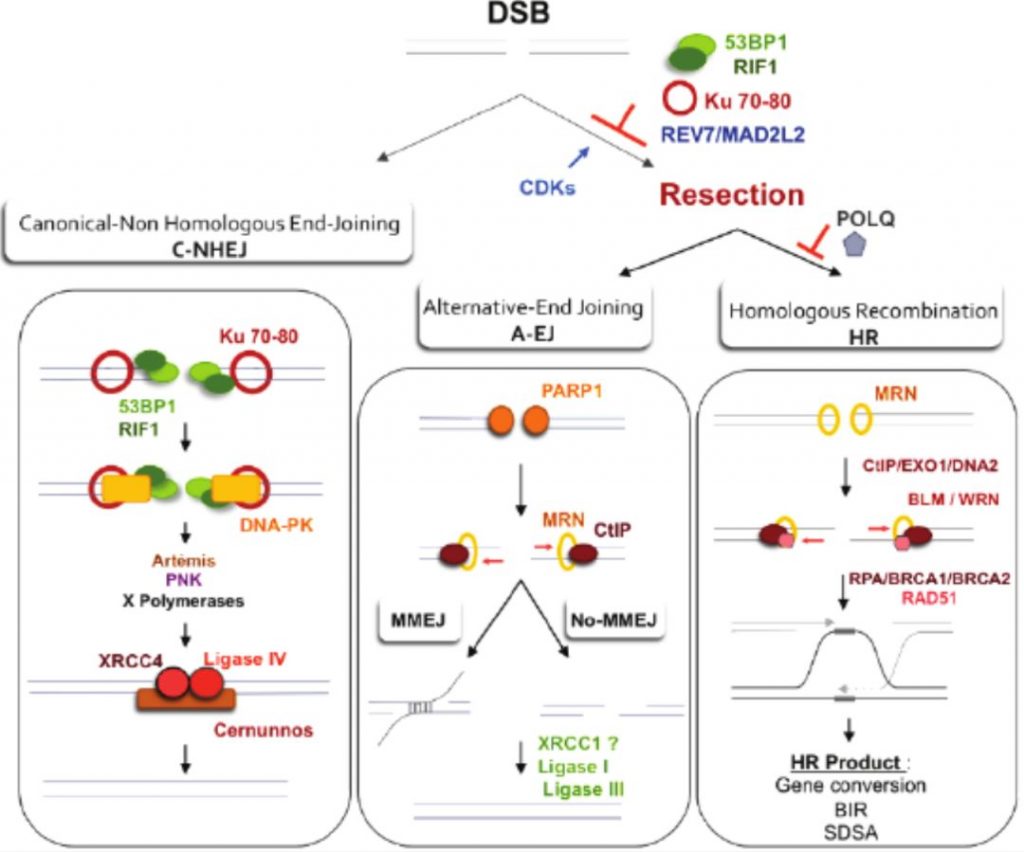
2,NHEJ非同源末端连接 (non-homologous end joining ):
NHEJ经典通路的DSB修复,断端会经过核酸酶的修剪和DNA聚合酶的填平空隙,所以DSB修复的DNA会有“伤痕”,可能是修复合成时新加入几个核苷酸或切除一些核苷酸;因此,在损伤末端重连处,一般会有几个核苷酸或几对碱基对的“伤痕”。
-
“伤痕”如果是在基因组的编码蛋白基因部分,会产生基因的蛋白序列异常,从而翻译后的蛋白其功能也相对应产生异常。
-
“伤痕”如果是在基因组的非编码区的话,这对细胞没有大的影响。(基因组非编码区比编码区空间范围大很多)
仅仅是粘合断裂的DNA末端,这个过程修复的高保真性是不确定的。在真核细胞中,主要发生在G1和G2期。
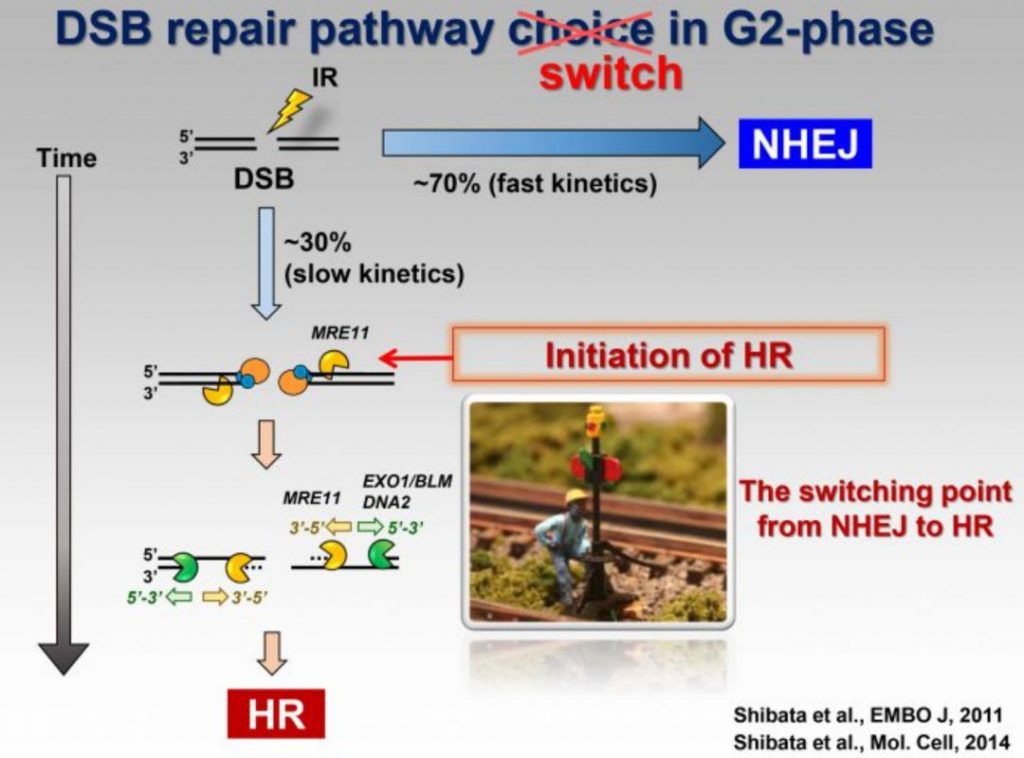
NHEJ途径可细分为两个通路:
i,经典(Classical pathway) 细胞信号转导通路:
第一步:某些DNA复制蛋白复合体会对整个基因组进行“巡查”,找“双链DNA断裂现象”的DNA断裂情况。其中一种蛋白是ku70/80,具有Loop环状结构的异源二聚体。DNA末端结合蛋白,能环绕在双链DNA断裂处,启动后续的级联信号反应。
第二步:“招募”作用于“DNA修复机制”的下游蛋白,其中一种非常重要的蛋白是DNA依赖蛋白激酶(DNA-PK:Protein Kanise),ku和DNA-PK共同将断裂的两端拉近靠拢。
第三步:DNA-PKs随后召集另外一种蛋白Artemis,Artemis同时具有DNA内切酶和外切酶活性,能处理损伤的末端。
附:DNA聚合酶是从5’端往3‘-OH端延伸,而且需要3‘-OH末端的引物作为引导进行修复合成;所有的连接酶具连接特定断端,即其中一端必须含有5‘磷酸(PO4),另一端必须有3‘-OH;辐射的损伤有可能破坏这些结构,细胞内需要一些酶修剪损伤的断端,使其可以被识别和被连接,这就是Artemis具有修剪DNA末端能力的意义。
第四步:DNA连接酶识别断端,进行DNA末端共价键连接修复。
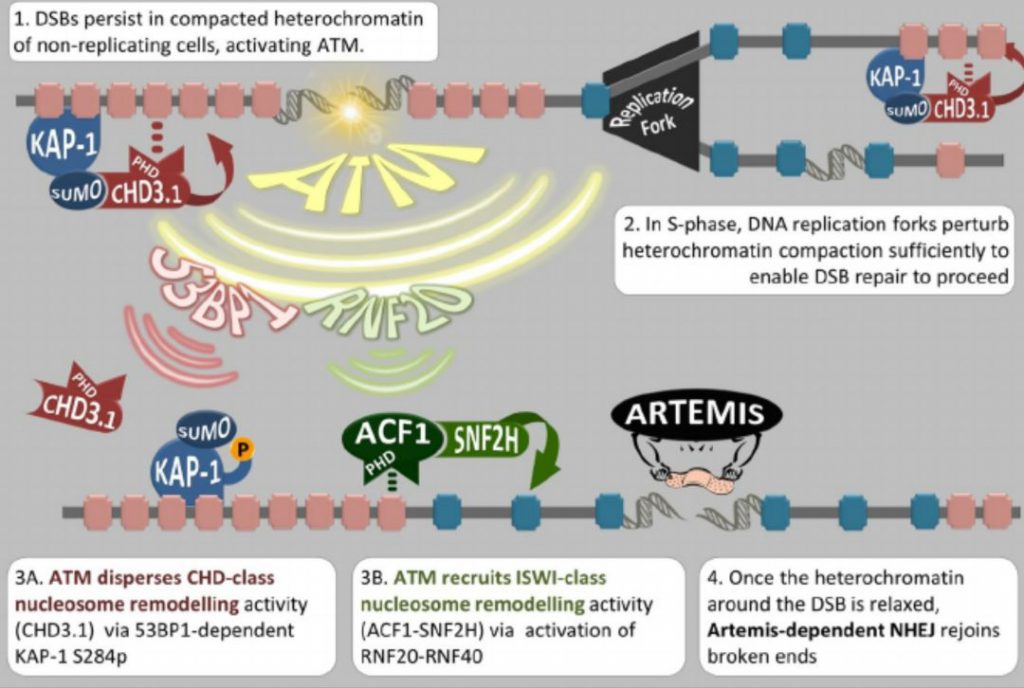
ii,旁路(Alternative pathway;error-prone pathway 易错修复) 细胞信号转导通路:
第一步:PARP1蛋白会对整个基因组进行“检查”,找出并结合在双链DNA断裂处,启动后续的级联反应。
第二步:分别召集一些DNA修复相关蛋白到DNA断裂处,处理损伤的断端情况。
第三步:一般这种情况的双链DNA的断裂形成“粘性末端”,有2-10对碱基对可以碱基互补识别;经过酶的断端修剪清理后,两个“粘性末端”可通过这个短片段的同源性优先识别修复。
第四步:连接酶结合到断端,进行DNA末端共价键连接修复。
https://www.researchgate.net/publication/
277944885_Replication_Stress_in_Mammalian_Cells_and_Its_Consequences_for_Mitosis
“同源重组”机制在双链DNA修复中的细胞生物学意义:
当同源重组发生错误识别时,在非模板染色体执行“修复”可能会给细胞带来无法预估的伤害。例如,错误的识别来自另一个亲本的同源物,而不是姐妹染色单体作为模板来“修复”损伤的染色体。因为母本和父本染色体在许多位置上的DNA序列是不同的,所以这种类型的修复可以将需要修复的DNA序列从母本转变为父本序列,或从父本转变为母本序列。
M-phase DSBs induce anaphase bridges and cause chromosome aberrations.
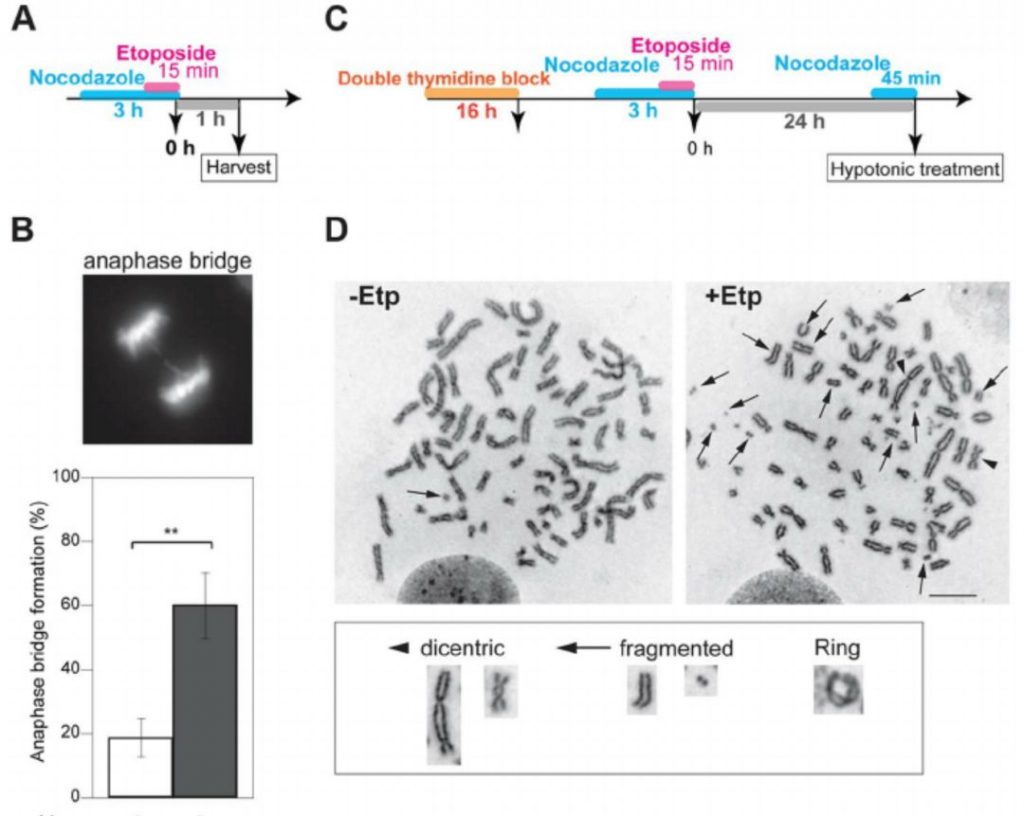
知识体系拓展:
目前已经发现的几种遗传形式的癌症是由于细胞在执行和调控同源重组中发生突变导致的。例如:Brca1和Brca2的基因突变会导致乳腺癌发病率显著增加。
Brca1基因的突变,不能合成有活性的蛋白(处理DNA末端损伤),导致“修复”低效,DNA损伤累积,从而引起癌症。
Brca2蛋白能与Rad51蛋白结合,阻止Rad51在DNA上聚合,从而使其保持无活性形式直至需要。在DNA损伤发生时,Brca2有助于将Rad51蛋白迅速带到损伤部位(单链DNA),一旦到位,就可以将其活性形式激活,发挥修复和同源重组的功能。

https://www.cell.com/trends/cell-biology/fulltext/S0962-8924(15)00142-7
启动子与sgRNA之间可以插入一个酶切位点吗
您好,请问在利用HDR介导外源基因定点整合时 (其中同源臂长度约800bp) ,其中同源臂中有几个点突变的,这个会不会影响其介导的定点敲入效率啊?
你好,请问如果转进去线性修复模板的话,用普通的胶回收试剂盒就可以么?质粒的话可以用去内毒素试剂盒提取,片段的话要怎么去内毒素呢?
您好,用crispr cas9做点突变的话,同源重组修复的DNA模板想用质粒载体连接,如何转到细胞里的话,这个修复模板的质粒载体有要求吗?做点突变的话,cas9的质粒载体和同源修复模板的质粒载体需要同时转到目的细胞里面吗?
您好 不好意思 给刚看见留言。实际上这边修复模板不需要质粒,可以直接是线性模板,即纯化的PCR产物,当然也可以为单链DNA,即可以直接合成oligo
进哥您好,请问可以把同源重组修复的DNA模板放到sgRNA的载体里然后通过慢病毒导进细胞吗?还有一个疑问是,如果使用慢病毒导入了sgRNA的质粒,过表达了cas9蛋白,那么cas9持续发挥作用,这个时候还能直接导入线性模板吗?会不会过一段时间模板没有了,但是cas9持续发挥作用导致细胞进行了NHEJ呢?
你好,我想请教一下。在做HDR修复的时候,给的ssDNA作为修复模板,但是结果发现有一部分修复的是错误的,比原序列(~500bp)要短100bp。请问这种情况如何产生的呢?期待答复~
你好,不好意思,最近写标书,没注意留言
看到这个邮箱略微有些亲切,我曾经在苏州药明康德实习过一年半
这个问题我可能也不是很确定,因为是同源重组的方法,依据的是同源臂互补配对,所以会不会有可能存在错配的情况,就和引物非特异性结合类似,导致错误的片段插入。这样的情况或许可以增加同源臂的长度