IND、 NDA、BLA、ANDA与OTC,是我们谈到一个新药时经常听到的词。它们分别代表什么?具体有什么区别?了解一下FDA整个新药的批准流程会让你更好理解这几个词的意义。
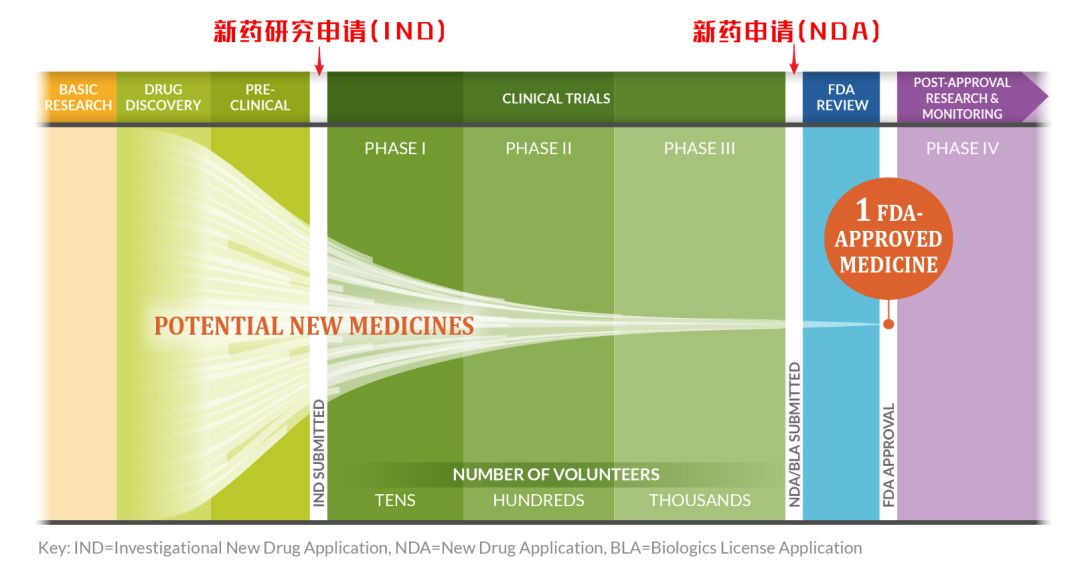
FDA的新药审评包括了两个过程:一个是新药临床试验申请(简称IND)审评过程,另一个是新药上市申请(简称NDA)审评过程。
名词短语:
IND:新药临床试验申请(Investigational New Drug)
NDA:新药生产上市注册申请(New Drug Application )
BLA:生物制品许可申请(Biologics License Application)
ANDA:仿制药注册申请(Abbreviated New Drug Application)
OTC:非处方药(Over The Counter)
FDA药品批准程序
FDA药品批准程序可大致分为以下几个步骤:
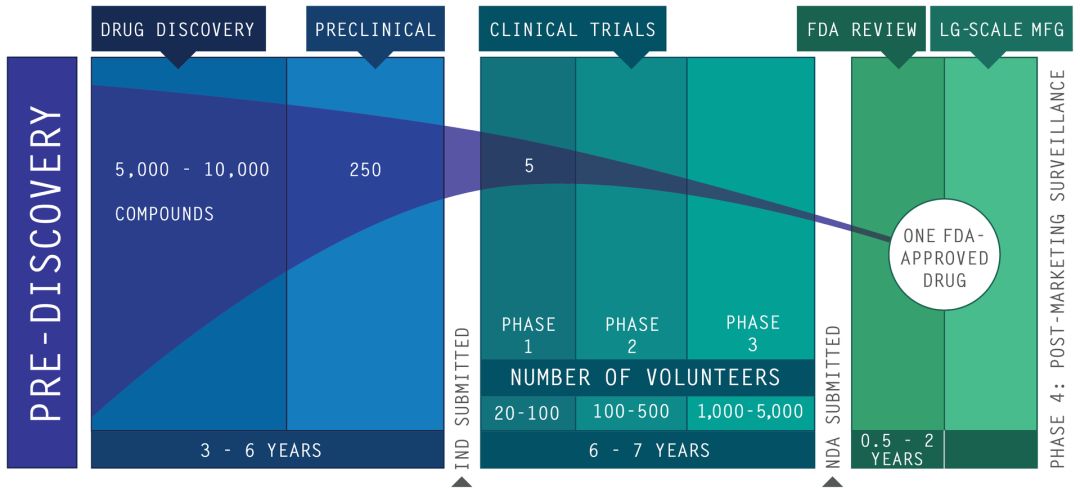
1.临床前试验(Pre Clinical)
研究人员将前期筛选出的新化合物进行动物试验,证明发现的新化合物对某种疾病具有生物活性,同时还会评估该化合物的安全性。
临床前研究用来评估:
(1)药品的药理学现象和作用机理(MOA);
(2)药物毒性特征和毒性靶器官;
(3)药物吸收、分布、代谢和排泄(ADME)。当药品申办者认为它已具有足够的数据证明该药是安全时,就可准备向FDA提交新药临床研究申请(IND)。
2.新药临床试验申请(IND)
化合物通过临床前试验后,需向FDA提交IND申请,以便可以将该化合物应用于人体试验。
详解新药临床试验申请(IND)
IND的英文全称是Investigational New Drug,中文被称为:新药临床试验申请。就是说当一个新药当决定进入临床试验时,则要向FDA提交IND(新药研究的申请),同时报送所有研究资料。FDA在收到IND以后,在一个月内必须给予答复。如果申请人在一个月内得不到FDA的答复,即表示已经批准进入人体试验,可自动进入临床研究。
美国法律规定,药品在被运输到其他国家时应是获得上市许可批准的。由于申办者可能会把在研药物交给其他国家的临床研究者,因此申办者必须寻求法律上可以豁免的一种方式。IND就是申办者严格根据法律意义在FDA获得豁免权的方式。
IND主要目的
提供足够信息来证明药品在人体进行试验是安全的,以及证明针对研究目的的临床方案设计是合理的。在IND申报阶段,FDA一般规定(最低限度)药品申办者必须:
(1)做该药的药理研究;
(2)在至少2种动物身上进行急毒试验;
(3)按照该药预想的用途进行为期2个星期至3个月的短期研究。一旦临床前研究结束,动物试验并没有随之完成,许多时间更长、更专项的研究如慢性、抗癌试验将在整个新药申请过程中进行。
3.临床试验(Clinical Trials)
临床试验(Clinical Trials)指任何在人体进行的药物的系统性研究,以证实或揭示试验药物的作用、不良反应及/或试验药物的吸收、分布、代谢和排泄,目的是确定试验药物的疗效与安全性, 临床试验一般分为I、II、III、IV期临床试验。
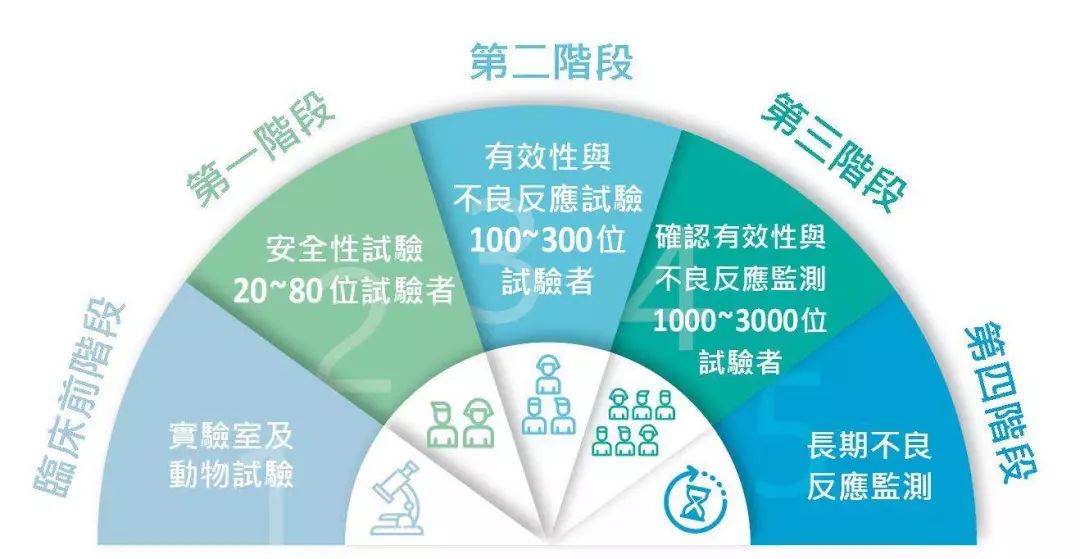
Ⅰ期:临床药理学及人体安全性评价。受试者为健康成年志愿者。
Ⅱ期:治疗作用初步评价阶段。受试者必须是患者。剂量探索阶段称为Ⅱa期,评估药物有效阶段称Ⅱb期。
Ⅲ期:治疗作用确证阶段。进一步验证药物对目标适应症患者的治疗作用和安全性,评价利益与风险关系,为药物申请的审查提供充分依据。
Ⅳ期:新药上市后应用研究阶段。考察在广泛使用条件下药物疗效和不良反应;评价在普通或者特殊人群中使用的利益与风险关系及改进给药剂量等。
4.NDA或BLA申请
在临床试验结束后,申请者向FDA提交NDA或BLA,申请批准上市。审评过程中如临床试验结果不详尽,FDA会要求补充试验以证明药物安全性和有效性。
生物制品许可申请(BLA)
BLA(生物制品许可申请) 是Biologic License Application的简称,是向美国FDA提交用于支持评审和最终批准生物制品在美国上市和销售的文件材料。
生物制品的上市销售申请是根据公共卫生医疗服务(PHS)法案中的有关条款进行批准的。该法案要求生产生物制品的公司在跨州进行产品销售时需要持有相关的产品许可证。
BLA指的是一个包含有生物制品的生产工艺、化学、药理学、临床药理学和医学影响方面特定信息的递交材料。如果提供的材料符合FDA的要求,那么申请便会得到批准并颁发给生产企业相关产品上市销售的许可证。
新药申请(NDA)
新药申请(New Drug Application),当申办者有足够理由能证明药品的安全性和有效性满足了FDA对于上市的要求时,申办者就可以向FDA递交NDA了。所有的新药要在美国上市必须经过新药评审过程。递交材料中必须包含如化学、药理、生物药剂和统计学等方面的技术材料供评审。
如果NDA获得批准,那么药品就能在美国上市了。此外为了便于内部追踪,所有的NDA申请都会有一个NDA号。一般NDA的评审与IND的评审是由同一个评审组评审的,但是NDA无疑会更为耗时。
植物药NDA申报材料与化学药品类似,主要包括以下内容:CMC数据、非临床药理和毒理数据、人体药代动力学和生物利用度数据、微生物数据、临床数据、安全性数据更新报告、统计学数据、病例报告表、有关专利情况、样品、包装及标签等。
一般符合以下情况均可向FDA提出NDA申请:
(1)新分子实体(NME);
(2)新化学实体(NCE);
(3)原批准药品相同化学成分的新盐基、新酯基;
(4)原批准药品的新配方组成;
(5)原批准药品的新适应症(包括处方药转非处方药使用);
(6)新剂型、新给药途径、新规格(单位含量);
(7)两种以上原批准药品的新组合。
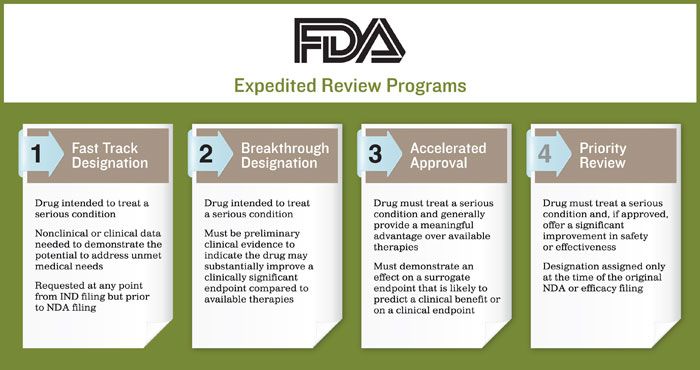
特殊审批通道
这里需要需要提一下FDA四条加快创新药品上市的特殊审批通道,其主要包括:突破性疗法(Breakthrough)、优先审评(Priority review)、快速通道(Fast track)、加速批准(Accelerated approval)。
5.批准上市(FDA Approval)
获批后,FDA会在网站公布药物批准类型及药物说明书。
仿制药注册申请
仿制药注册申请ANDA的英文全称为Abbreviated New Drug Application,中文称为仿制药注册申请。
仿制药需要在原料药、剂型、规格、给药途径和使用条件(除非因专利问题无法做到使用条件相同)等方面与已上市药品相同。不仅如此,仿制药还需要跟原研药在质量、作用和适应症( intended use )上与原研药一致,故又被称为通用名药或非专利药。
他们在FDA的申请被称为“ Abbreviated New Drug Application ”,是因为所仿制的原研药生产商已经做了动物和人体的相关实验并证明了药物的安全性和有效性,因此仿制药申请不需要重复这些实验,只需要科学地证明仿制的药品与原研是生物等效的即可。
(1)仿制药的基本要求:
仿制药的基本要求是要实现仿制药与原研药的治疗等效( Therapeutical Equivalence ), 而仿制药要实现与原研药的治疗性等效,不仅需要与原研药药学等效,
还需要与原研药能够生物等效。
主要包括:
a. 活性成分必须与原研药相同。
b. 剂型与原研药相同。(若原研药是片剂,那么仿制药也必须是片剂,不能做出胶囊或其他剂型。FDA甚至还要求仿制药的外形与外观,与原研药要保持近似但又不能够完全雷同。)
c. 规格与原研药相同(如原研药是30mg,那么仿制药品也必须是30mg)。
d. 服用方式相同,例如原研药是口服,那么仿制药也必须是口服。
e. 使用条件需要相同。
f. 仿制药的强度、纯度、质量等方面与原研药相同。
g. 仿制药的生产条件需要原研药相同。
对于一般口服制剂来说, FDA不要求仿制药的辅料(一些特定的关键辅料除外)与原研药一样,但是对于注射剂来说,仿制药的辅料(缓冲液、防腐剂、抗氧化剂除外)是需要与原研药保持一致的。
(2)生物等效(BE,Bioequivalence)
生物等效(BE,Bioequivalence) 是指仿制药和原研药到达人体的时间和速度是相当的。通常证明生物等效的一个常见的方法是测定仿制药到达健康人体( 24-36 名)血液所需的时间和血液浓度,如果仿制药能够在同样的时间内将同样量的活性成分传输到人体的血液中,则视为二者等效。
BE试验是为了比较仿制药和原研药体内吸收程度和吸收速率,因此提供源于BE试验的数据是ANDA申报资料中一个关键的组成部分。与评估药学等效性一起,确立生物等效性允许在药政监管层面上做出治疗等效性的结论。
非处方药(OTC)
OTC是over the counter的缩写,即非处方药,是指那些不需要医生处方,消费者可直接在药房或药店中即可购取的药物。
非处方药是由处方药转变而来,是经过长期应用、确认有疗效、质量稳定、非医疗专业人员也能安全使用的药物。
对每类非处方药,FDA都制定了一个专论,凡是符合专论的药品,可以直接作为非处方药上市而不必得到FDA的批准。但如不符合专论,在必须单独经过新药申请评审过程,但这一过程主要用于新的活性成分第一次作为非处方药的情况。