首先,为了对肿瘤转移模型有更加清晰的理解,我们先来了解一下,肿瘤转移的过程。
一、肿瘤转移过程
肿瘤细胞的转移过程(如图1):原位侵袭(Local invasion),肿瘤细胞内渗(Intravasation),循环系统存活(Survival in the circulation),肿瘤细胞外渗(Extravasation),形成转移灶(Micrometastasis formation)等过程[1]。
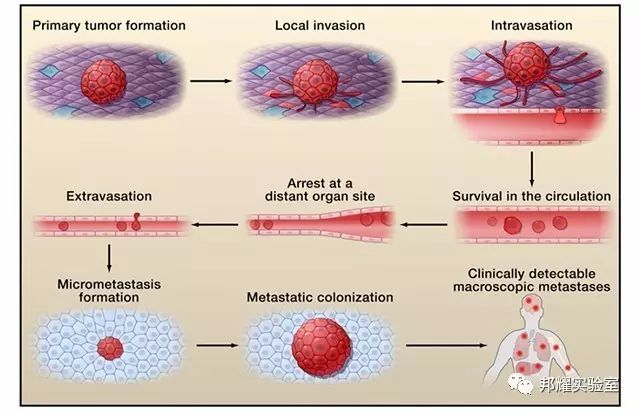 图1.肿瘤转移的基本过程
图1.肿瘤转移的基本过程
可以形象地解释如下:
第一步:离家出走;肿瘤细胞在原位侵袭,离开原发灶,内渗进入血管、淋巴管,进而获得血液提供的营养;
第二步:绝处逢生;进入血液循环系统后,作为一个异己分子,逃避机体免疫系统,最终较少的肿瘤细胞成功存活;
第三步:鸠占鹊巢;在适合生存的环境开始生长,并从循环系统渗出,到新的组织器官增殖并形成转移灶;
第四步:繁衍生息;新环境生存稳定后,肿瘤细胞打败了原有的住户,逐渐增殖扩大同时,又计划转移到其他器官。
二、常用的肿瘤转移模型
一般根据肿瘤细胞接种方式,主要分为以下几种转移模型:
1. 尾静脉注射
肿瘤细胞经尾静脉注射后,先通过肺部的毛细血管网进入动脉血液循环系统,可造成全身多发转移灶。但是由于肿瘤细胞较为粘稠易聚团,一般会被困在小鼠肺部微血管,主要形成肺转移,可能后期会造成远端器官的转移。主要用于建立肿瘤转移(血行通路)模型或血癌模型或者肿瘤肺转移。
2. 左心室注射
肿瘤细胞经过左心室注射进入小鼠体循环,细胞经过粘附,降解及迁移等过程,最终造成不同器官的转移,可以很好的模拟肿瘤的血道转移过程。一般多造成骨、脑等部位转移。
3. 原位注射
将肿瘤细胞移植于小鼠相应器官,如人乳腺癌细胞移植到裸鼠乳房垫上,人的肝癌移植到裸鼠肝叶上。该模型可模拟转移的全过程,包括最初侵袭组织,穿入血管和形成转移灶等步骤,更加接近人类肿瘤转移的过程。因此原位模型广泛用于抑制肿瘤转移和生长的药物筛选。
4. 腹腔注射
将肿瘤细胞注射到小鼠腹腔,操作简单,可出现一定比例的浸润、转移和腹水。主要是观察肿瘤细胞在腹腔内的转移情况,但是腹腔血液循环相对较少,不利于肿瘤转移的发生,适合某些肿瘤转移过程,如卵巢癌。
5. 其他注射方式
除了上面常见的几种转移模型,还有用到的如:爪垫皮下移植(因爪垫皮下有丰富的淋巴管,可研究淋巴道转移);肾包膜(肾包膜血管丰富,可立即供给移植肿瘤充分的氧及营养);脾脏注射(可造成肝转移模型)等。
在上述的转移模型中,我们一般是根据肿瘤类型和研究目的,选择最适合模型,如研究乳腺癌转移过程,我们查询文献发现乳腺癌易转移到骨、肺部,因此如果想研究乳腺癌的转移后期阶段的着床、生长、血管生成等及肿瘤转移的药物的筛选检测等,会选择尾静脉注射和左心室注射模型。如果想研究肿瘤转移全过程,并研究抗肿瘤增殖和转移的药物筛选,我们会选择原位移植模型。
本期主要介绍前2种肿瘤转移模型:左心室注射和尾静脉注射的构建过程。
三、2种转移模型的建立
细胞系和小鼠的准备:
如上期的皮下荷瘤模型基本一致,首先是需要选择合适的细胞系和小鼠,需要注意的是:
(1)细胞系的选择:选择临床中侵袭性强的癌细胞。同时,由于体内转移不易监测,所以可构建带有荧光素酶(Luciferase)标签的细胞(如MDA-MB-231-luc,CT-26-Luc),利用荧光素酶与荧光素作用时生物发光的原理,在IVIS小动物活体光学成像系统上更直观地检测原位肿瘤细胞向内脏器官的转移情况。
(2)细胞接种量及稀释:每只小鼠注射100μL左右,1×105个细胞(注入到血液的细胞相比皮下少,因为细胞聚团易堵住血管,造成小鼠死亡)。
(3)其他准备器材:注射器,冰盒、麻醉剂阿佛丁,注射器,75%酒精棉球,手术保温机。
(一)尾静脉注射
1. 尾静脉注射步骤
我们在往期具体介绍过,可参考1.7 尾静脉注射实验技巧;
尾静脉注射步骤视频:
2. 后续分组与实验分析
在注射细胞当天,利用IVIS活体成像系统检测小鼠体内的肿瘤细胞,根据读值进行分组,一般每组准备10只小鼠,因为小鼠会发生死亡,所以至少保证可获得每组5个数据。可分为对照组,阳性药物组,低剂量,中剂量和高剂量药物处理组,当天给药。
如下图为,尾静脉注射腺癌细胞MDA-MB231-luc后,利用IVIS监测肿瘤转移,可看到癌细胞主要发生在肺部[2]。
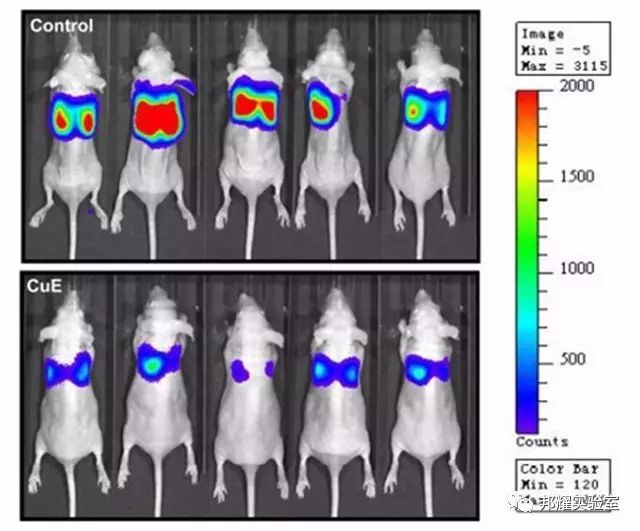 图2. 尾静脉注射后IVIS 监测肿瘤细胞的转移
图2. 尾静脉注射后IVIS 监测肿瘤细胞的转移
(二)左心室注射
1. 注射步骤
① 裸鼠经麻醉、仰卧式固定、酒精棉球消毒;
② 轻按胸部,在胸骨左侧第二,三肋间进针(靠近胸骨),注射器内留有气泡时,针头进入左心室;
③ 进针3-5mm,以观察到鲜红血液喷射涌出进入针管,回血液面随着裸鼠心率搏动上下起伏,作为进入左心室的标准;
④注射,在10s 内完成;
⑤注射完毕后缓慢拔针,棉签按压进针点;
⑥裸鼠放置保温台待苏醒;
⑦接种后的裸鼠置于SPF环境内饲养,并密切观察。
注射时的注意事项:
1. 注射到左心室的标准是什么?
针头有鲜红色血柱喷出,因为左心室为动脉血,血色鲜红,心肌有力,所以针头进左心室后,会有鲜红色血柱喷出。如为暗红色血,进入的为左心房,建议进针位置下移。
动图1
2. 如果没有看到血丝是什么原因,该如何处理?
如果针头未进入心室,只进入心肌层或胸腔,则无血溢出。建议在附近调整进针位置。
3. 小鼠扎针后流血怎么办?
如果进针创口过大,可能造成小鼠血流不止,因此要小心操作;如果血流不止,建议直接处死小鼠,不建议进行试验。
左心室注射步骤视频
2. 后续分组和数据分析
如尾静脉实验一致,注射当天就可根据IVIS结果进行分组,当天或者隔天给药。同样分为对照组,阳性药物组,低剂量,中剂量和高剂量药物处理组(n=10)。
如下图为,左心室注射MDA-MB231-luc 乳腺癌细胞后,利用IVIS 监测肿瘤转移,可看到主要在骨和脑部有癌细胞,并结合拍X光分析乳腺癌转移导致的溶骨现象[3]。
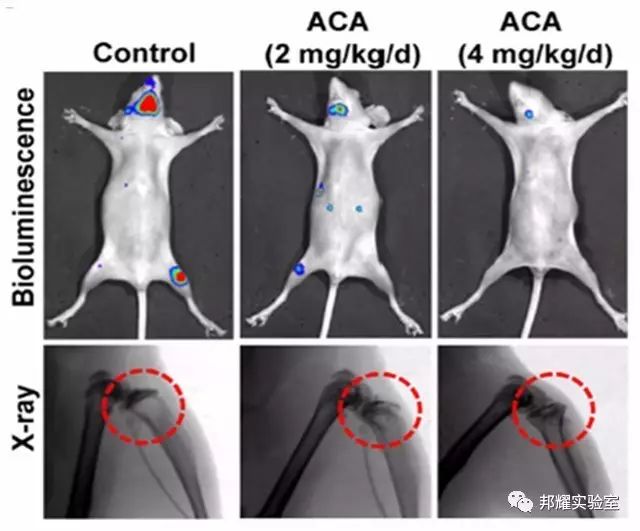
图3. 左心室注射后IVIS 监测肿瘤细胞的转移(上)X光拍摄的溶骨现象(下)
注意:由于以上二者模型均是直接将肿瘤细胞注入血液,进入小鼠血液循环,会对小鼠机体正常代谢影响较大,因此必须密切观察,并定期称重,当裸鼠体重减轻20%或者低于16g 时,或出现嗜睡、行动迟缓、呼吸短促、食欲下降等异样症状是,需要结束实验,安乐处死小鼠。
本期就先为大家介绍这2个肿瘤转移的动物模型,与皮下荷瘤相比,转移模型构建难度明显加大,但也是我们经常用到的药物筛选模型;与尾静脉注射相比,左心室注射难度会更大,需要自己夺多花功夫摸索。下一期,我们会继续为大家提供另外的肿瘤转移模型的构建,大家持续关注哦!
视频提供者:孟云
参考文献:
1. Valastyan S, Weinberg R A. Tumor Metastasis: Molecular Insights and Evolving Paradigms[J]. Cell, 2011, 147(2): 275-292.
2. Zhang T, Li J, Dong Y, et al. Cucurbitacin E inhibits breast tumor metastasis by suppressing cell migration and invasion.[J]. Breast Cancer Research and Treatment, 2012, 135(2): 445-458.
3. Wang J, Zhang L, Chen G, et al. Small molecule 1’-acetoxychavicol acetate suppresses breast tumor metastasis by regulating the SHP-1/STAT3/MMPs signaling pathway[J]. Breast Cancer Research and Treatment, 2014, 148(2): 279-289.
感谢大佬的讲解,网页的鼠标效果好酷炫!
请问一下,您是否遇到过肿瘤模型构建中出现肿瘤造模未给要就自己体积减小,有采取什么方法解决吗
老师您好,转移模型构建成功后如何获取转移灶上的肿瘤细胞,这个您了解吗?
您好,想请问您,我的实验设计是将肝癌细胞皮下注射到小鼠上,成瘤后处死小鼠,再将肿瘤切除并切成约1 mm3的小立方体,然后植入另一批经过预处理小鼠的肝叶。这种操作能够使小鼠肺转移嘛?还想请问原位种瘤的肺转移模型成功率高吗?
您好,请问腹腔注射卵巢癌细胞模拟的是转移模型还是原位模型呢?直接腹腔注射后检测腹腔肿瘤负荷情况。(目前临床上认为卵巢癌、原发性腹膜癌属于同病同治)
老师你好,我想问一下,尾静脉转移模型具体的细胞量大概多少呀,我是打的LLC(小鼠肺癌细胞)
您好,我想问一下,既然是建立肿瘤转移模型(比如;建立乳腺癌肺转移动物模型),那原位种植那个方法是指将乳腺癌细胞种植到裸鼠乳房垫,后续是会得到 “裸鼠发生乳腺癌肺转移的结果”,这样理解对吗?
对比其他的方法而已,这个方法更接近临床实际情况,是吗?
您好,请问一下,您了解到的有没有皮下瘤构建转移模型的,有相关文献在用吗?
有应该是有的,但是科学性没有原位瘤好,有局限
您好,请问一下,有没有皮下瘤的转移模型,你了解到的有相关文献再用吗?
感谢,请问CRC肝转移模型如何构建?能否详细说明
你好,我不做结直肠癌,相关模型不太清楚,你可以去一些模型动物公司网站查看
这篇文章也可参考一文带你了解「结直肠癌」动物模型的建立及选择 – 知乎
请问如果没有荧光标记的细胞系,是不是就不能用这个转移模型了?
如果没有标记的话,只能肉眼观察转移结节,加上HE染色,比较麻烦
尽量使用荧光标记细胞
请问除了荧光素酶标记的细胞,能不能用带有GFP标记的载体稳转细胞注射呢
可以的,当然
是否符合动物伦理
邓老师您好,就我所知,就实验操作而言确保减轻动物痛苦就符合伦理,也就是手术操作需要麻醉进行