

来,不用休息了,来提问吧~最后请将你想问的问题告诉我们,我们会一一为大家解答。留言方式见文章最后~
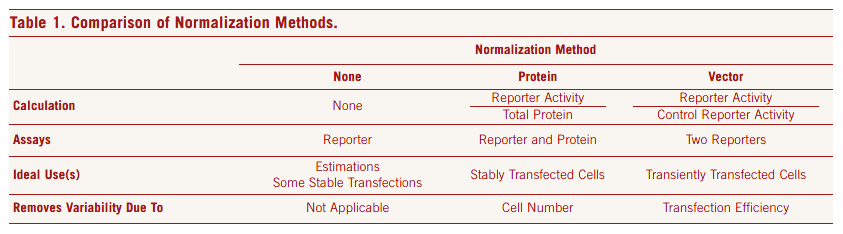
通常选择带有组成型表达启动子的海肾萤光素酶表达载体来作为内参,主要包括 pRL 系列和 pGL4 系列中的部分载体。
理论上,内参载体和主报告载体并非一一对应,例如 pGL3 系列载体,既可以选择用 pRL 系列载体作为内参,也可以选择 pGL4 系列海肾萤光素酶表达载体作为内参。不过,不同时期的载体产品表达效率可能会相差较大,使用同一代产品,两者的表达效率相近,更容易调整两种载体共转染比例,这可能是大部分使用者更常见的选择方案。
同一代的不同海肾内参载体之间,最主要的区别是携带的启动子不同,包括 CMV、SV40、TK 等。通常,内参基因表达的活性应当显著的高于背景组,同时,尽量小,确保不干扰主报告基因的表达。所以,我们建议选择内参载体时,首先考虑活性较弱的 TK 启动子驱动的载体(例如 pRL-TK,pGL4.74)。当通过文献资料或者预实验,发现该载体在目标细胞模型中表达效率过低,或者会受到实验研究因素干扰时,再考虑其他表达活性更强的载体(例如 pRL-SV40 或 pGL4.75),或自己构建所需的特殊启动子载体。
pGL3 和 pGL4 系列载体有啥区别?
pGL3 系列包含 luc+firefly luciferase gene,pGL4 系列包含优化的编码基因 luc2 firefly luciferase gene,在哺乳动物细胞中表达效率更高;pGL4 系列还包含携带优化的海肾萤光素酶编码基因 hRluc 的载体。
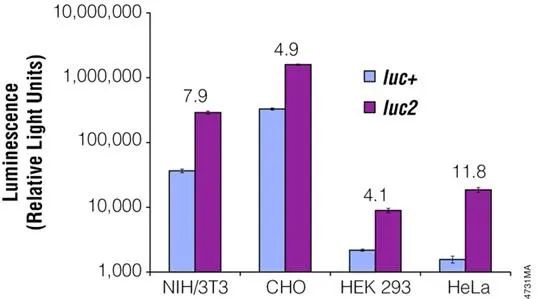
与 pGL3 载体相比,pGL4 载体骨架结构中与转录因子结合位点一致的序列,也大大减少。本底表达值更低,信噪比更好,被非特异调控的可能性更低。
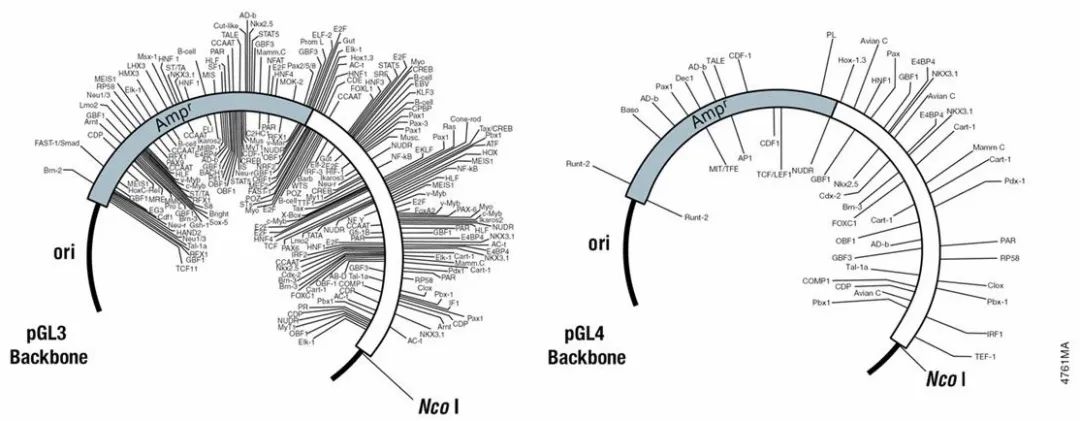
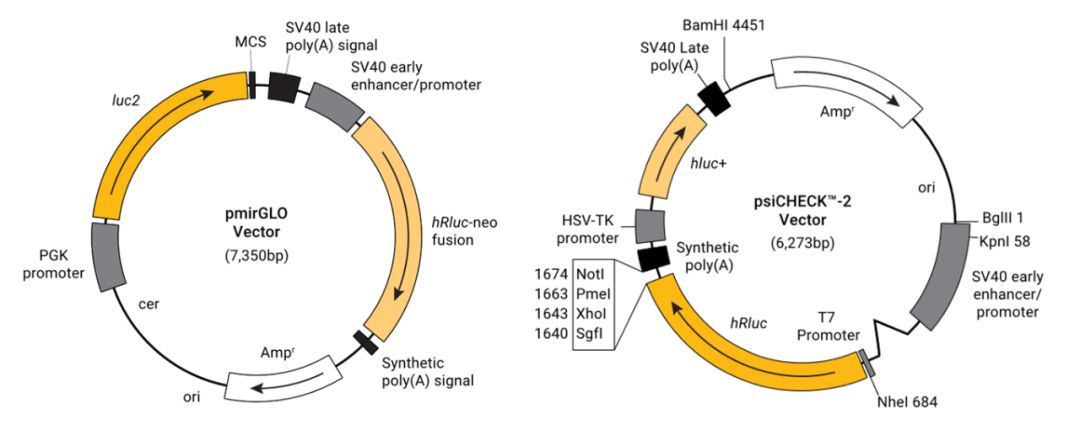
pGL4 系列中增加了预构建的信号通路研究载体,带有快速应答功能载体和带有稳定筛选标签的载体,应用更灵活方便。
你好,双荧光素酶技术是可以通过转入内参基因来消除转染效率的干扰,那么Nanoluc有没有消除转染效率的方法呢?是否也可以通过转入内参基因来消除?
你好,原代细胞做双荧光素酶报告基因实验,荧光虫值8000左右,海参一直很低300-200,为什么呢?
你好!请问有m6A文章将目的基因BNIP3的3’UTR转到pmirGLO质粒的F-luc下游,再转到敲低FTO(调控抑制BNIP3)的细胞中,这种改变FTO表达的细胞怎么引起转了3’UTR的pmirGLO表达荧光素酶变化呢?困惑了很久,打扰了
要是有的,就是一个技术方法用到你的实验中,理论上完全没有问题,文章你看一下这些看看有没有帮助:https://www.ncbi.nlm.nih.gov/pmc/?term=luciferase%20UTR%20m6A&report=imagesdocsum
用荧光报告载体用于m6a位点的研究,将cds区构建进载体内,需要考虑移码的问题吗?有点懵
不用吧,m6A报告基因这个没做过,应该只要不涉及到翻译过程都不用考虑
你好,请问植物的双荧光素酶技术是怎样的呢?目前在做miRNA和转录因子互作,但是相比动物,植物的该实验感觉做的比较少,miRNA也多在哺乳细胞中研究,所以想咨询一下植物的双荧光素酶实验,非常感谢!
可以的,你可以加我微信:18021308280