众所周知,研究非编码RNA必定要对LncRNA/circRNA进行亚细胞定位,研究非编码RNA亚细胞定位的方法有:荧光标记探针进行原位免疫荧光(FISH)、分离胞浆和胞质的RNA进行PCR检测。当然经费充足的话FISH是首选,即可定性也可定量,还有细胞照片,可信度最高。但是实验室没这条件,外包不放心还死贵。所以我选择后者。
目前已知的分离胞浆和胞质的RNA的标准方案有:Ambion® PARIS™ Kit (Catalog number: AM1921)和Norgen Biotek公司Cytoplasmic & Nuclear RNA Purification Kit (NGB-21000)。以上两种试剂盒都是有大量文献使用的,但是价格较贵(约4500块/50T)。廉价替代方案还是有的:碧云天P0028+RNase Inhibitor (参考帖子https://www.dxy.cn/bbs/newweb/pc/post/31149116)
碧云天P0028是用来抽提胞浆和胞核蛋白质的,但是咨询技术后我得知试剂盒中不含有破坏RNA的组分,目前确立了如下Protocol:
- 所需仪器、用品与试剂:
细胞核蛋白与细胞浆蛋白抽提试剂盒(Beyotime P0028)、RNase Inhibitor(Beyotime R0102)、Trizol试剂、无酶EP管、移液枪、无酶枪头等
- 操作步骤:
1. 准备溶液:使用前从-20℃冰箱取出P0028试剂盒,室温融解试剂盒中的细胞浆蛋白抽提试剂A和细胞浆蛋白抽提试剂B,溶解后立即放置在冰上,混匀。取适当量的细胞浆蛋白抽提试剂A备用,在使用前数分钟内加入RNase-free Water稀释的RNase Inhibitor,使其最终浓度为1-2U/µl。(所有试剂置于冰上备用)
2. 对于贴壁细胞:用PBS清洗一遍,胰酶消化细胞,并计数。低速离心收集细胞,弃培养基,PBS洗一遍,低速离心收集细胞,尽最大努力吸尽上清,留下细胞沉淀备用。(置于冰上)
3. 对于悬浮细胞:细胞计数后用PBS洗一遍,离心收集细胞,尽最大努力吸尽上清,留下细胞沉淀备用。(置于冰上)
4. (冰上操作)每20μL细胞沉淀加入200μL添加了RNase Inhibitor(含未稀释的R0102 10μL)的细胞浆蛋白抽提试剂A。(对于二百万HeLa细胞,其细胞沉淀的体积大约为20μL或40mg。)
5. Vortex 5秒,把细胞沉淀完全悬浮并分散开。(如果细胞沉淀没有完全悬浮并分散开,可以适当延长vortex时间。)
6. 冰浴10~15min。
7. 加入细胞浆蛋白抽提试剂B 10μL。Vortex 5秒,冰浴1分钟。
8. Vortex 5秒,4ºC 12000g离心5分钟。
9. 立即吸取上清至一预冷的塑料管中,加入Trizol抽提细胞浆RNA。(千万不要触及沉淀,可以在沉淀上方保留极小体积的上清,以免触及沉淀。)
10. 对于沉淀,完全吸尽残余的上清,加入Trizol抽提细胞核RNA。
11.以下步骤同Trizol法提取总RNA。
RNA抽提质量评估:
1.RNA浓度:A260 x dilution factor x 40= μg RNA/mL;
(1 A260= 40 μg RNA/mL)
注意DNA污染,否则A260吸光值增加。
2.RNA产量:标本不同,产量相对也不同。但基本产量范围是固定的。
105的细胞=1 μg,1mg组织=1~10 μg
3.RNA纯度: A260:A280=1.8-2.1
4.1%琼脂糖凝胶电泳UV成像观察条带:胞浆可见明显28S/18S 双条带,亮度略低于总RNA,而胞核双条带亮度很低。
下图为标准方案中的PARIS试剂盒提取质检图(变性琼脂糖凝胶电泳)
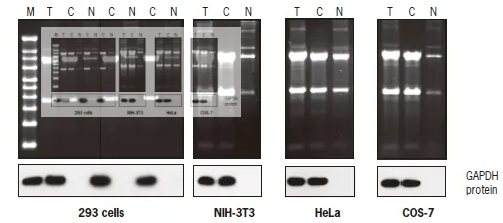
T total C cytoplasmic N nuclear
国产替代方案RNA提取后质检参考图片:
等做完实验加上图
强烈建议抽提之后进行电泳评估抽提质量后再进行PCR操作。
核质分离实验注意事项:
1、核质一定要分离干净,吸取胞浆上清的时候一定不要吸到沉淀,同样地,对于沉淀,要完全吸尽残余的上清(吸到沉淀无影响)。
2、无论什么方法分离必定有损耗,所以不用纠结。
3、RT-PCR加样时务必保证加入了等量的胞浆RNA和胞核RNA,这样才能使用简化公式。
4、使用最优引物保证在较大浓度范围内扩增效率接近100%,否则不能使用简化公式。
结果分析方法(简化公式):
核%=2^-胞核CT值/(2^-胞浆CT值+2^-胞核CT值)
质%=1-核%
公式原理:本人称之为假定内参法
假设有基因Z,基因Z在胞浆和胞核中各占比50%,同时取1000ng胞浆RNA和胞核RNA进行逆转录得到cDNA,在用此cDNA进行PCR(不稀释或者稀释同等倍数),那么PCR得到胞浆RNA和胞核RNA的基因Z的CT值必定一样(显而易见么,加样时基因Z的模板量一样,其他条件相同),我假设CT值都是15,而GAPDH的CT值,胞浆14,胞核16,那么以胞核GAPDH的相对表达量为1,胞浆GAPDH的相对表达量用2^-ΔΔCT 计算就是4,最终得到GAPDH的质%为80%,核%为20%。
同样的,以目标基因Y在胞核的相对表达量为1,目标基因Y在胞浆的相对表达量计算结果就是

实际操作:
1、导出PCR结果CT值到Excel
2、按简化公式计算对应比例
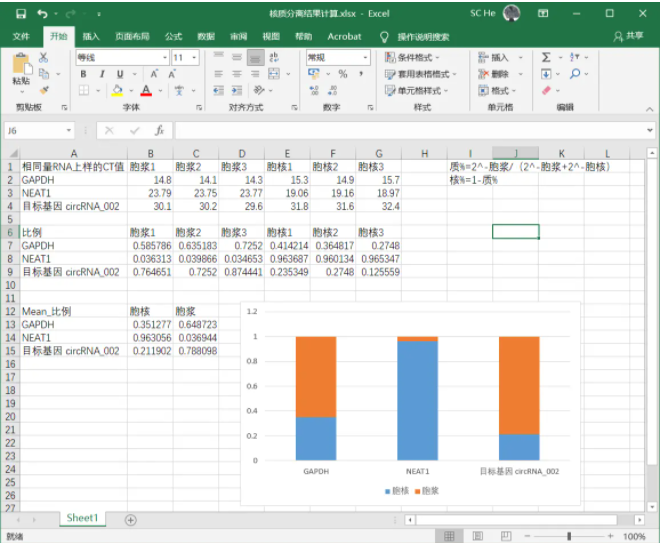
3、结果导入GraphPad画图
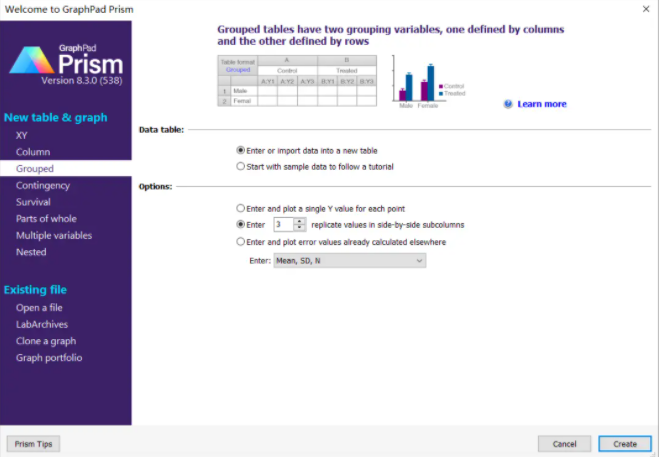
新建数据,选择Grouped,3个重复
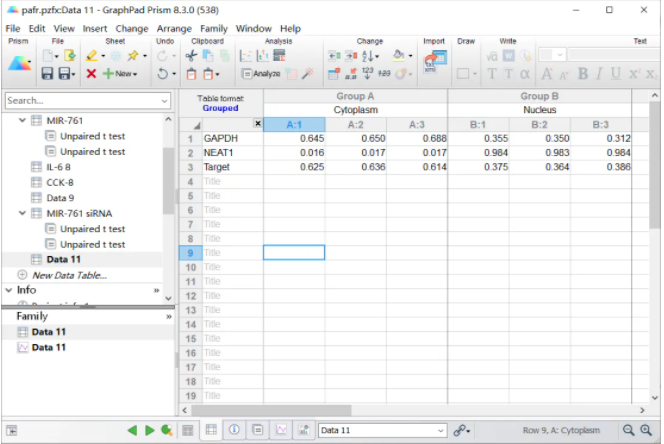
把Excel计算好的结果数值复制过来
选择二维分组柱状图
本文参考:https://www.dxy.cn/bbs/newweb/pc/post/31149116
你好,我不是很能理解为什么核和质都要加入同样的量去反转录。
假设细胞质total RNA有100ng, 细胞核total RNA有200ng。Gene A 在细胞质中有10ng,在细胞核中有40ng。在真实情况下Gene A的核质比应该是80%。如果核质均取相同量,假设细胞核和细胞质均取50ng,那么Gene A在取出的细胞质中有5ng,在取出的细胞核中有10ng,这时候的核质比是66.7%,和真实的情况不一致。
期望得到解答,感谢!
王老师,Norgen Biotek公司的核质分离试剂盒可以同时提取RNA和蛋白质嘛?在哪一步可以提细胞核蛋白和胞质蛋白呢?
进哥,你好,我采用的试剂盒是Norgen Biotek公司Cytoplasmic & Nuclear RNA Purification Kit ,分析结果后95%的GAPDH 在胞质,但是60%的U6也在胞质,我重复了好几次实验都是这样,造成U6在胞质的原因是什么呢?是第一步裂解太充分了吗?第一步裂解液我裂解两分钟U6还在胞质,希望进哥给我答疑解惑,谢谢进哥啦!
我用的Norgen的试剂盒,做了3次了。每次的结果都是目的lncRNA在胞质比胞浆明显多,但是内参U6和β-Actin的结果却没有差异,胞核和胞浆内看不出差异,想请教是什么原因呢?
您好,我想问一下,18S可以作为核内参吗?谢谢解答
请问这个U6内参引物设计还有特殊的地方么,我有同学做micro用的是U6内参,可以拿来直接用么?另外那个RNA inhibitor的剂量具体是多少呢,前面说是稀释到1-2U/ul,后面又变成未稀释的原液10ul了,一瓶2000U的只有40ul的量,买一管只能做4个样本了。。
U6我网站上有序列:https://www.jingege.wang/2022/08/03/%e4%ba%ba%e5%92%8c%e5%b0%8f%e9%bc%a0u6%e5%92%8ch1%e5%90%af%e5%8a%a8%e5%ad%90%e5%ba%8f%e5%88%97%e5%8f%8aqpcr%e5%bc%95%e7%89%a9/,至于抑制剂,参考说明书使用量加入,不同厂家有区别
进哥,请问做lncRNA的可以用U6做核内参吗?
王博,我用的细胞核质蛋白分离试剂盒分离到最后,核质都是液体状态,如果需要用trizol法提取RNA,是直接加入trizol还是先离心弃液在加trizol呀
你好,我不是很能理解为什么要用相同的核质RNA进行逆转录。假设细胞质 total RNA有100ng,细胞核 total RNA有200ng,gene A在细胞质的量是10ng,在细胞核中的量是40ng,此时真实的核质比是80%。假设取相同的量做反转录,细胞核和细胞质均取50ng,则gene A在细胞质的量是5ng,在细胞核中的量是10ng,此时的核质比是66.7%,和真实情况不一致。
下面的内容也是抄袭的b站一位up主的,和丁香园那个是同一个人
谢谢提醒,最下面有注明来源的,这个网站主要是我的个人笔记,顺便方便大家一起学习。转载的内容一般都会注明来源
您好,我想问一下步骤中有一个加入200ul含RNase inhibit 的试剂A,到底含有多少A试剂呢,前边不是说要把RNase inhibit稀释到1-2u/ul,有点没搞懂具体的试剂添加情况
进哥你好。请问第九步和第十步,加入Trizol后体积是不同的。假设加入500ulTrizol,胞质的体积更多。这个会影响最终结果吗?
你好,这个全程最好保证胞质和核提取逆转录 qPCR步骤一致,你说的是胞质是液体,相对核体积更大,那这样同样的trizol下会不会有影响,这个的话可以使用多一点的trizol,一般1ml也够了,多一点会更好
谢谢回复。还有个疑问,使用碧云天试剂盒裂解细胞后,沉淀是细胞核。拿Trizol很难裂解呀,很暴力才行,不知这个对最终结果有无影响,我做了一次,因为胞质离心时震出来一些,结果不准确。不过感觉有戏
还是失败。。。能私聊请教一下吗进哥
当然可以 导航栏个人简历有联系方式
问题解决了吗?我们现在也是感觉Trizol裂解不开
进哥你好。请问第九步和第十步,加入Trizol后体积是不同的。假设加入500ulTrizol,胞质的体积更多。这个会影响最终结果吗?
请问18S在细胞质内比例是90%+,但是U6在核质内各占一半是什么原因呢,是细胞核泄露吗?
也许吧,好像也不应该,再做做看看吧 然后再讨论
你好,重复了一次,结果还是一样不成功,18s在细胞核的比例3%,细胞质中97%,U6在细胞核中65%,细胞质中35%,我用的是Norgen的试剂盒分离的,请问是什么原因呢进哥哥
请问你用norgen试剂盒,吸上清的时候,会不会容易吸到底下粘稠的核RNA啊,我试了好多次都会吸到,请问怎么解决呢
王博,想请问一下,我最近在做核质分离实验,最近一次结果显示U6在核、质分布差不多,GAPDH在核里面0.7,冰浴时间25分钟左右,细胞数大概6百万;trizol提核的时候只加了1ml,最后浓度检测质的浓度有一千多,核的一百多。想请问一下我可以从哪里改进一下?
你好,这个猜测可能是分离细胞浆时有核污染,可能是涡旋过于剧烈 也有可能是冰浴时间过长,建议从这两个操作进行优化
请问一下,我做出来了和例子中同样的结果,请问这算成功了吗! 质内参基因在细胞质中的表达量比在细胞核中高不了多少,这算成功吗!
大不了多少是多少?尽量差的大一点更好。在于裂解和吸取上清的步骤
重点是核RNA(例子中是NEAT1,也可U6等)那个比例一定要高,因为质中肯定没有,而质RNA是在核中转录 也会存在
norgen试剂盒分离 gapdh细胞质百分之90,细胞核百分之10, NEAT1,细胞核百分之90细胞质百分之10, U6细胞核百分之40细胞质百分之60,用的293T和SW480细胞都做过,结果都一致,这个U6是有什么问题吗
进哥我想问下 我的lncrna u6 都是在核中都是0.7左右,但是actin都是0.6左右这是什么原因呢,是不是因为actin不太适合作为胞质内参用gapdh好一点?
不是,应该是核质分离不太理想,成熟actin和gapdh都主要在细胞质
不放心再检测一下gapdh
进哥那你觉得在哪里改进下比较好呢比如第六步我是冰浴15分钟改为30分钟可以吗
可以 这种方法需要摸索条件 不同细胞可能也不一样
进哥!我做成果了! 感谢感谢你太厉害了?
恭喜?
进哥我还有一个问题就是这种pcr 的话是分别做三次统计呢,还是做一次用三个复孔统计就行
哈哈 这个问题其实和做其他实验一样,严格来说你三个复孔的数据仅仅是技术平行,而非生物平行;而所谓三次结果 指的是生物平行。
这个是严格要求上,具体如何看你自己了
你好,我想请教一下,我提完以后qPCR结果显示U6在核和质分布差不多,GAPDH在核反而多一点,冰浴时间我大概花了二十多分钟。想问一下我应该在哪里改进比较好?
老哥你改动的地方多吗,只有你说的15min增加为30min?还是有其他变动得地方,能说一下吗,我这边还是不成功,已经重复做了好多词了,谢谢
进哥,感谢分享,国产的替代方案效果怎么样哇,能做小RNA吗,你的国产质检图是不做完忘了上了
可以的,就是有时候步骤操作不太可控,可能得摸索最合适的条件
进哥你好,我是苏大附一院的21级学生,我得到的结果发现,GAPDH和U6以及目的lncRNA都是在细胞核中比例非常高,大于0.9的样子,请问你知道这是怎么回事吗,谢谢您
您好 不好意思 这两天忙着写标书 没时间看网站留言
这个没什么其他怀疑的 就是第一步裂解不充分,导致全部细胞成分都沉淀下去,作为细胞核进行后续操作了
您好,我分离完成之后按照同质量进行qPCR实验,GAPDH和U6全部都集中在细胞核中表达,同样的样品我进行westron blot验证分离的没有问题,但是提取的质RNA的总量有核RNA的3、4倍,想知道问题出在什么地方。
您好 这个我就不清楚了,能考虑到的可能就是你的质RNA降解了
我的核质分离之后,GAPDH和U6在细胞质和细胞核中各占一半呀,请问这个是因为细胞核有细胞质的污染吗?怎么解决呀?
你好 各占一半。。。那就是说明没有分离成功,已经不是单纯的没有吸干净导致的污染。你确认一下实验步骤,只能重新用细胞提取
进哥你好 请问如果想要分析一种mRNA的胞核胞质分布情况,胞核胞质的内参选择不一样的话还能进行比较吗?
您好,实际上这个分析的时候并不是和一般qPCR分析用的2^(-△△Ct),本文中有介绍计算方法。用到的GAPDH/U6在这里是作为细胞质和细胞核的标志分子,用以验证核质分离的可信度
核内参都用gapdh可以吗?
gapdh mrna主要在细胞质,不能用于核内参
可以选择U6,它主要在核内
请问进哥哥之前有用过这个U6的小鼠序列么?我用常规的primerbank找这个序列并没有找到primer。可否能推荐一个序列呢?
你好 小鼠可以和人一样的人和小鼠U6和H1启动子序列及qPCR引物
做LncRNA的核内参用什么?除了这个NEAT1
可以用U6,U6用的偏多
那核内参用18S怎么样?我查文献有用它的,但是我提RNA做qPCR发现18S在胞浆比胞核还多。
如果同时加入RNase Inhibitor和PMSF,可以同时提取胞核胞质的RNA和蛋白吗…
当然可以,按照共提的流程提取上清RNA和蛋白,完全可以,就是麻烦了。如果样本不是很珍贵,没有必要这样
请问碧云天这个试剂盒是不是不能像PARIS那样同时提取胞核胞质的RNA和蛋白呀
这个试剂盒仅仅能够做到分离细胞核和细胞质,还要结合共提试剂盒,才可以完成提取步骤