1. 流式细胞术:是基于细胞或颗粒光学散射特点和荧光信号差异对单个细胞或颗粒进行统计分析的一种检测方法。
2. 流式抗体:与普通抗体的不同,是偶联荧光素的抗体.
表达某一抗原的细胞与偶联荧光素的抗体特异性结合,经过流式细胞仪检测区时荧光素被激光激发,发射出的荧光信号被接收。
分析时反推回去:某种荧光信号→某种流式抗体→某种抗原→某种细胞。
3. 流式图:流式仪将接收到的光信号转化为电信号,经计算机转化为数字信号,绘制成图呈现。
一、流式图解析
1. 单参数直方图
2. 双参数散点图
3. 等高线图和密度图
流式数据分析的过程实际上就是在流式图上选门和设门的过程。
设门:是指用门选择某一或某些特性的细胞,是定性细胞亚群的重要方法。可以是单一门,可以使逻辑门。
门:可以是任意形状,可以封闭,可以开放(十字门)。门是人为设定的区域,有主观性,所以要设置对照使更客观。
设门需要考虑的因素——对照的设置
1). 必须有不染色的细胞作为空白对照
2). 抗原抗体的结合是否是特异性结合
a. 用同型对照判断是否存在非特异性结合
b. 用Fc block阻断细胞上的Fc受体非特异结合流式抗体
c. 用死活染料排除死细胞的干扰
3). 用阳性对照检验染色方案是否可行
4). 不同荧光素重叠光谱之间的补偿,单染管对照,FMO对照。
1. 单参数直方图
a.横坐标代表荧光信号或散射光信号相对强度,可以是线性或对数坐标。
b.纵坐标一般是相对细胞数。
下图中,细胞样品染CD3 FITC抗体为例,通过横坐标的荧光强度,把此细胞样品分为两群,左边一群是CD3 negative,右边一群是CD3 positive,进而我们可以知道此细胞样品中CD3阳性细胞的比例是多少。
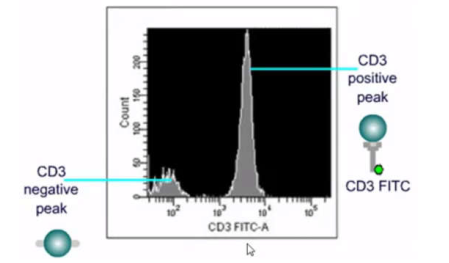
下图是单参数直方图的应用:
分群情况(下图):
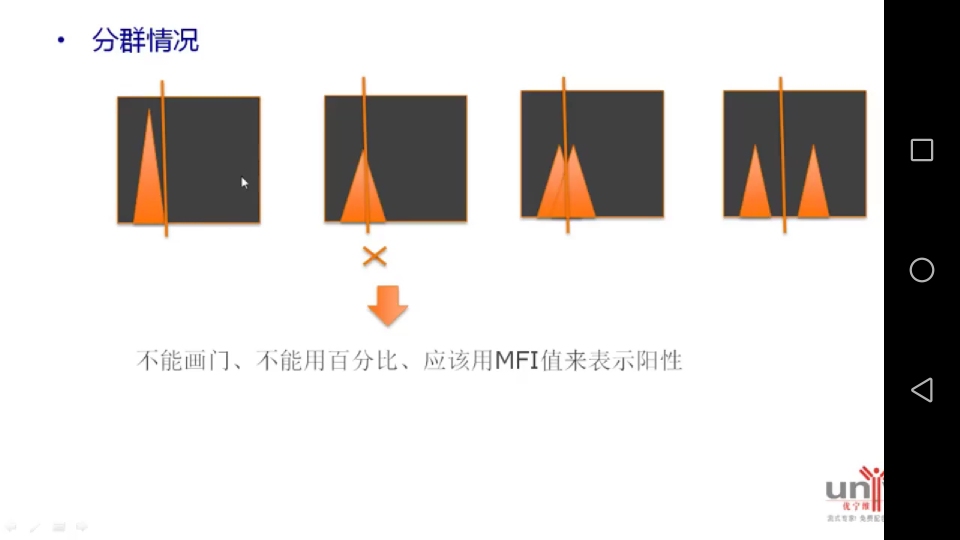
第一张图是:空白不染的细胞的检测图,
第二张图是:一个样本管,
第三张图是:有两个尖尖的峰顶,
第四张图是:很明显的两个峰,
其中,第三张和第四张画门正确,第二张图画门不正确,不能画门,不能用百分比,应该用MFI值表示阳性群,因为图二中群体比较均一。MFI中的M在大多数情况下是指mean值平均荧光强度。
mean,median,mode,Geom mean的区别:
mean是平均荧光强度,其缺点是:如果在当下视野里,细胞群体过大或过小,mean重复呈现性就会比较差。如果细胞群体都在视野里,可以用mean值。
median是荧光强度的中位数。100个细胞中50和51取个平均值。
mode是众数,是一组数据中出现次数最多的数量。峰顶对应的荧光强度即众数。
Geom mean是几何平均数,是指n个观察值连乘积的n次方根。
如果不是正态分布时,可以用Geom mean.
这四个值中,mean和Geom mean都可以代表整个细胞群的情况。mediun和mode只代表单一细胞的荧光强度。
选择用哪个值,是根据流式图的分布。在标准的高斯分布情况下,median=mean=mode,通常在流式中因为总会有异常值(超高或超低值)的存在,不是完美的高斯分布,建议使用medium,降低异常值对数据的影响。
2. 双参数散点图
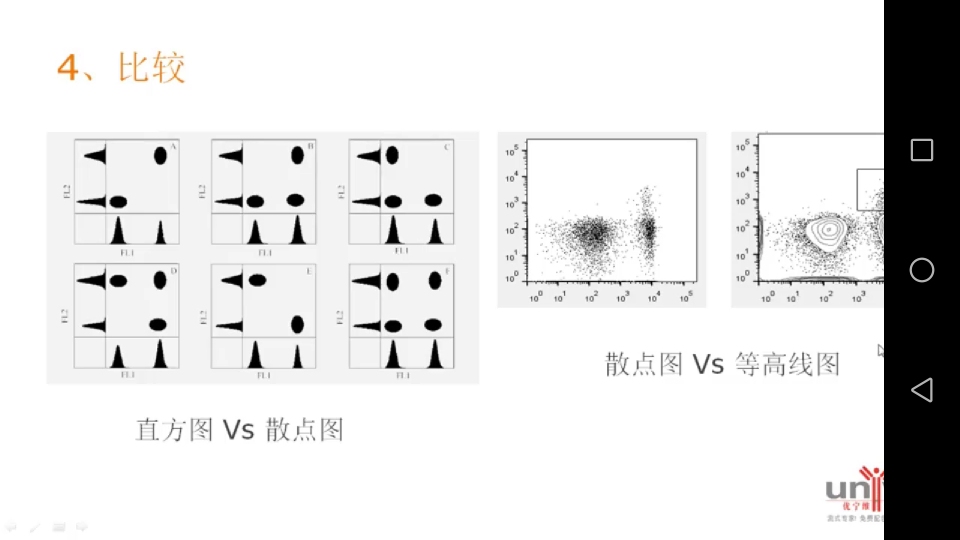
散点图比直方图提供更多的信息。
等高线图比散点图更易分群。
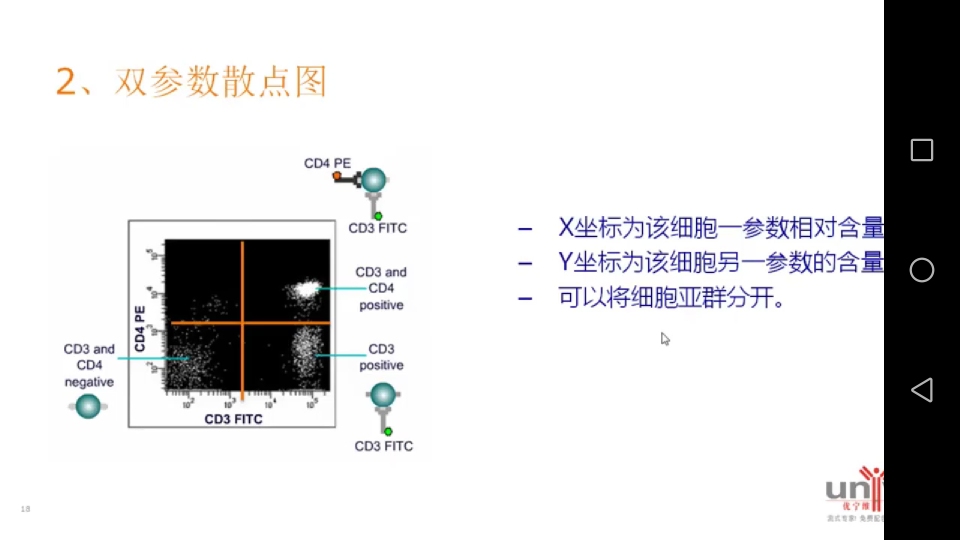
横坐标和纵坐标都是光信号,十字门左下角是双阴性群,右下角和左上角是单阳群,右上角是双阳群。散点图上的每一个点可以代表某一个细胞的信息。
3. 等高线图和密度图(略)
4. 比较
二、补偿调节
1.荧光素补偿来源
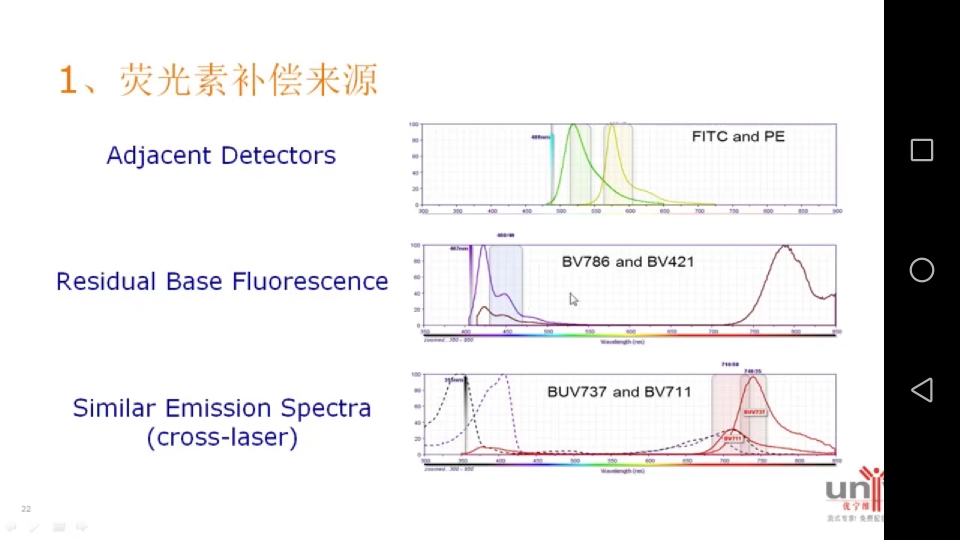
a. adjacent detectors相邻通道的补偿:FITC和PE两通道互相逸漏。
b. residual base fluorescence偶联素相互之间的补偿
c. similar emission spectra(cross-laser)不同激光器激发,但是因为光斑的影响,也会逸漏滤光片相邻的两个通道。
2. FITC compensation
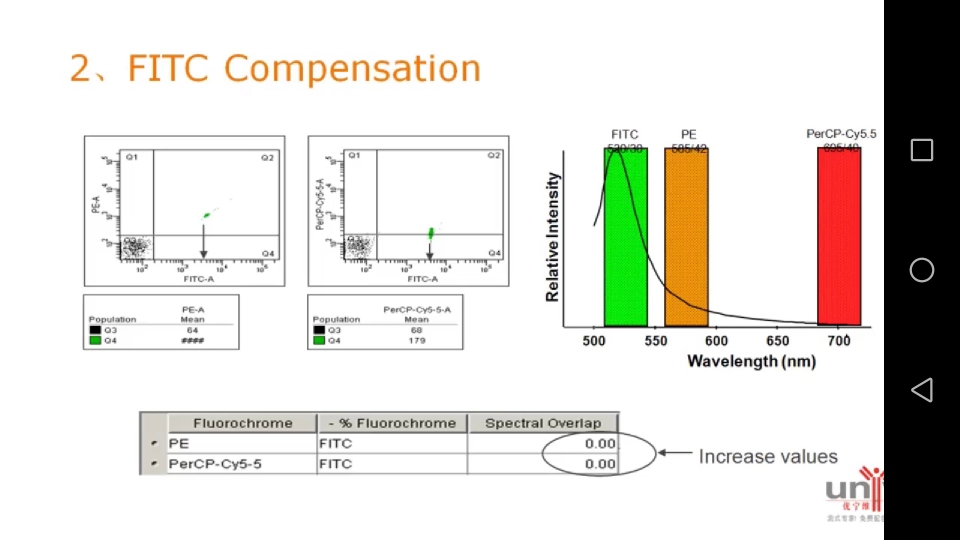
先上未染色的细胞作为空白对照,以调节各个荧光通道的电压;
然后单染管上样,比如上样FITC单染管,发现细胞群会飘到PE和percp-cy5.5通道里,会出现在双阳区域Q2。
调节补偿的原则:上谁的单染管就减去谁的通道里的光。
调完以后(下图),细胞群只落到了FITC单阳区。
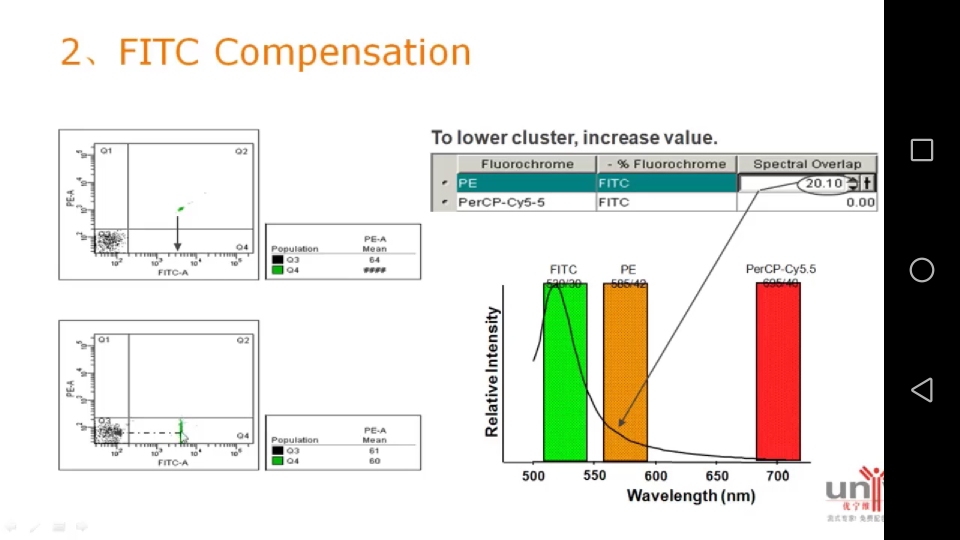 调补长需要注意:
调补长需要注意:
1. 同质性:不同细胞自发荧光强度不同
2. 阴性群:必须要有阴性群体
3. 阳性群:阳性群数量不一定要很多,但是阴阳群体一定要分得开。