固定是为了保持组织/细胞和活的时候状态一致,在组织学研究中经常会用到。在流式染色中,有的时候也会用到固定,今天就和大家来聊聊流式实验中固定相关的一些常见问题。
1. 流式实验中,哪些情况下需要对细胞进行固定处理?
检测细胞内指标
我们在流式胞内实验时,比如检测细胞因子(如 IFN-γ)或者核内转录因子(如 Foxp3)的时候,在样本染完表面指标后,一般需要先进行固定(或者固定破膜一起),然后再进行破膜(打孔)以及后续的胞内指标染色操作。
延长样本的保存,获得充足的上机时间
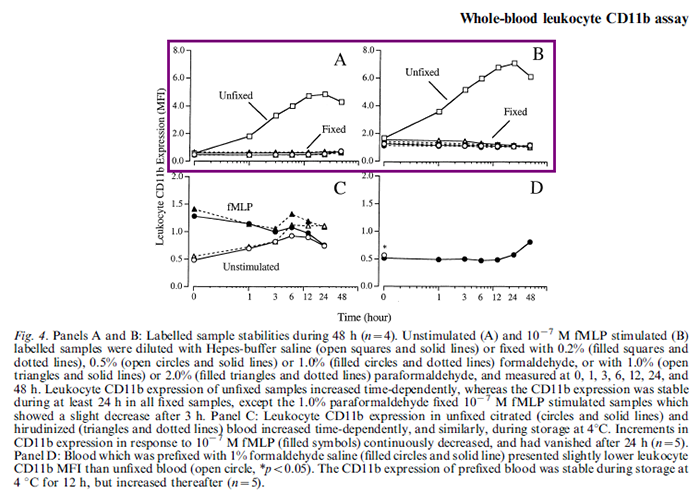
最常见的情况是染色处理完已经到很晚,平台老师已经下班或者自己的身体已经扛不住通宵做实验了,这个时候需要对样本进行固定处理,放到第二天检测,这里的固是定为了保持检测指标的稳定性;另一方面,当样本特别多的时候,第一管样本和最后一管样本的时间间隔会很久,这种情况下考虑上机前做一下固定,保持前后数据的一致性,比如 CD11b 这个指标在白细胞中的表达会随着样本放置时间的增加而上调。
生物安全性考虑
做流式的同学们都知道,流式检测的样本多种多样,有可能我们接触的样本是疾病相关的,有的时候甚至是传染病相关的。比如临床检测的样本有可能来自于 HIV 病人,在这种特殊的情况下,我们希望能够对样本做固定处理或者是预固定处理,这样会大大增加操作人员的安全性。
对蛋白翻译后修饰的检测
在蛋白翻译后修饰(磷酸化、乙酰化、甲基化等)的研究过程中,固定剂不仅可以有效的「固定」住翻译后修饰的位点(丝氨酸、苏氨酸、酪氨酸等),也可以防止目标位点在活细胞中很快降解(比如磷酸酶会去除磷酸化修饰、去甲基化酶会移除甲基化修饰等)。下面的例子是用 IL- 6 的重组蛋白刺激人外周血 15 分钟后看 STAT3 第 705 位酪氨酸的磷酸化水平,在刺激完样本后就需要通过固定来实现目的氨基酸磷酸化水平「停留」在 IL- 6 刺激 15 分钟这个节点上。
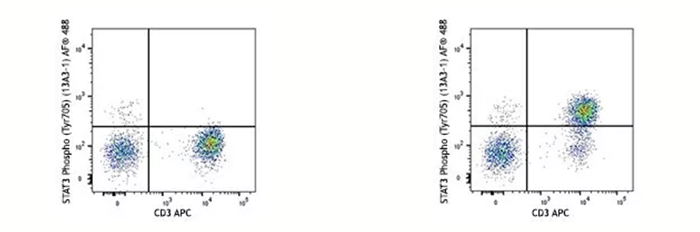
左图:未用 IL- 6 刺激,细胞固定后染色;右图:用 IL- 6 刺激 15 分钟,细胞固定后染色。
2. 常用的固定剂有哪些?
脱水剂类(如乙醇、甲醇)
可以溶解脂类物质,使细胞脱水,使蛋白沉淀到细胞结构上,后续染细胞内指标不需要额外的破膜步骤;这类固定剂会使蛋白质的三维结构发生变化,很容易造成抗体识别的表位发生改变,从而影响一部分抗体的染色效果。
交联剂类(如甲醛、C5 H8O2)
通过自由氨基基团把分子桥连起来,从而能够保持大多数目标蛋白/抗原构象的完整性;但也会使识别某些氨基酸残基的抗体不能与这些基团结合,所以后续胞内指标的染色除了需要先用破膜试剂进行打孔外,染色的过程也需要在破膜剂中进行。此类固定剂中最常见的是 4%PFA,其有效成分实际上就是甲醛。
3. 流式实验中固定会遇到的问题及应对建议?
理想的固定剂能使抗原固定,同时保持细胞、亚细胞结构的真实性,同时能够保证抗体与所有细胞及亚细胞结构内抗原的充分接触。但「理想很丰满,现实很骨感」,固定的过程或多或少对流式检测带来一些影响,只有了解了固定对流式染色带来的影响我们才能更好的做好流式实验。
固定对荧光染料的影响是什么?
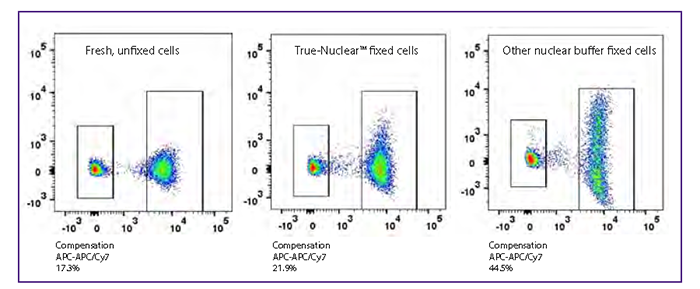
主要表现在固定剂对串联染料(tandem-dye,如 APC/Cy7、PE/Cy7 等)的影响:一个是固定剂有可能造成串联染料的断裂,比如 APC-Cy7 和 4%PFA 接触时间超过 4 个小时染料就有可能断裂,所以如果细胞直接重悬在固定液里面建议尽快上机,如果要放到第二天上机,需离心去除固定液后重悬在流式染色液或者是 PBS 里面,当然有一些新的串联荧光素可以有效减少这种情况,比如 BioLegend 的 APC/Fire750TM 染料。
另外一个是固定剂有可能造成串联染料的荧光「溢漏(spillover)」增加,对于这类情况的建议是配色允许的情况下减少串联染料的使用(但实际上很多多色 panel 来说,这都不算是一个解决方案);另外,使用一些商业化的固定 buffer,也有可以在一定程度上减少荧光「溢漏」,如下图所示:
4%PFA 固定后的样本可以保存多久?
一般建议不要超过 24 个小时,固定后的样本放置时间越久,背景信号会越高,即使固定后的细胞重悬在不含固定剂成分的缓冲液中也会造成背景升高(我们建议固定后的样本离心除去固定剂,重悬在流式染色缓冲液或者 PBS 里面)。
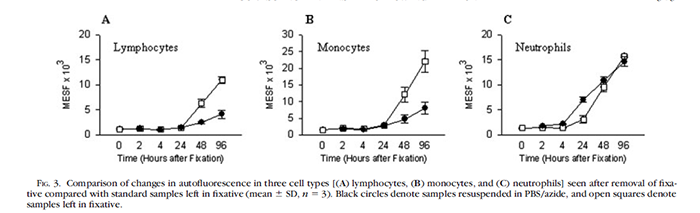
如果需要长时间保存样本,建议在样本做完表面染色和固定后,保存在专门的保存缓冲液中。但即便是有专门的保存 buffer,对于用了串联染料(如 APC/Cy7、PE/Cy7 等)染色的样本,我们还是建议不要长时间保存,很难避免补偿的「漂移(shift)」。
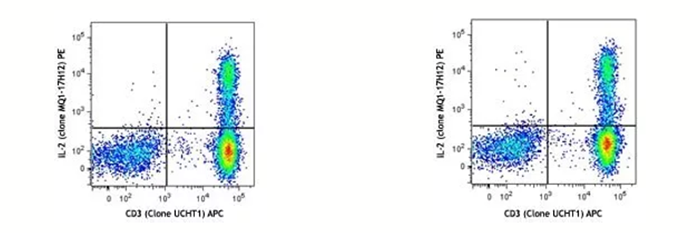
左图:human PBMC 刺激完当天染色后上机检测;右图:同一样本,表染和固定后,保存在 Cyto-Last™ buffer 里面,14 天后做胞内染色并上机。
Ki- 67 染色时,选择哪种固定方式?
流式在检测一些特殊的核内指标时,一般都会有推荐的固定破膜方案。比如在 Ki- 67 染色一般会推荐用 70% 的冰乙醇作为固定剂(含打孔作用),如前文提到的脱水剂类固定剂对蛋白空构象的影响大,在单染 Ki- 67 的时候,乙醇的固定方式是完全没有问题的,但是在和其它指标共染时,就需要考虑乙醇固定的方式和其它抗体兼容性的问题,比如 CD38 (Clone: HIT2) 的抗体是明确不能和乙醇固定的方式兼容,而 CD34 (Clone: 581) 很大程度上可以兼容这种固定方式。醇类和其它抗体(Clone)的兼容性很难一一验证,所以在做 Ki- 67 染色的时候我们也会用 FOXP3 的固定/破膜方式来替代乙醇的方案,而且大多数时候是可以获得不错的染色结果。
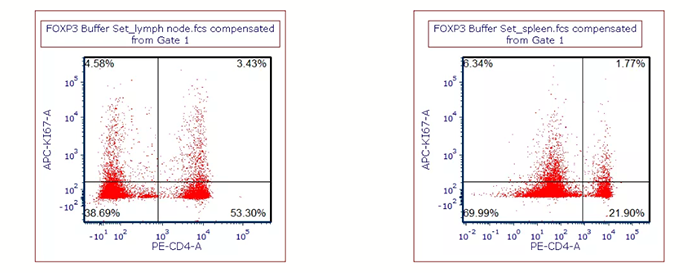
用 BioLegend FOXP3 Buffer set 对细胞进行固定破膜处理后,染 Ki- 67 抗体,左图:小鼠淋巴结样本;右图:小鼠脾脏样本。
对于需要先固定再染色的样本,注意点在哪里?
流式实验中,有一些情况我们希望或需要对样本进行预先固定处理,比如前文说过的传染病人的样本或者是需要检测蛋白翻译后修饰的样本。对于需要预固定的样本,首先需要考虑预先固定处理对检测指标的影响,有很多指标先染色再固定和先固定再染色出来结果差异非常大,导致这些差异原因和指标的类型、抗体的克隆号等因素都有关系。
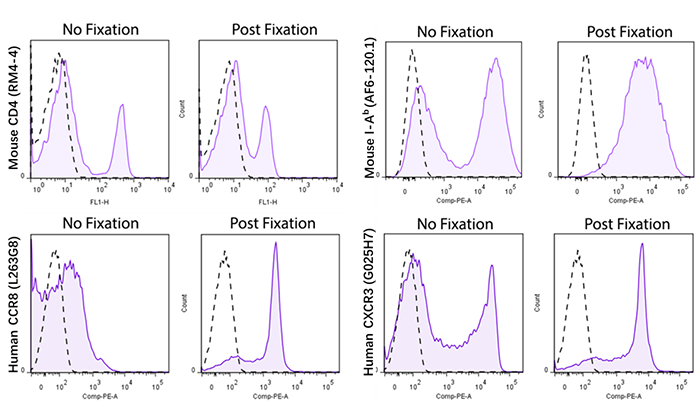
如果我们的流式实验要求对样本进行预先固定的处理,那实际上这就需要提前去验证染色方案里所选的克隆是否适用于先固定后染色,这也有一定工作量。推荐大家参考借鉴 BioLegend 关于固定的专题,里面有做了很多克隆能否适用于先固定后染色的验证。
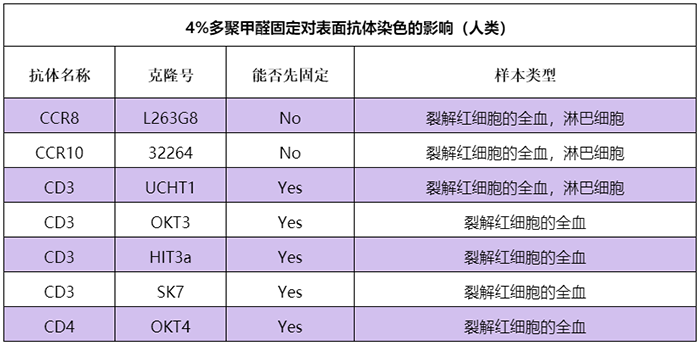
对比信息请参考:www.biolegend.com/fixation
样本需要先固定再染色,但方案里的一些指标不兼容预先固定,该怎么办?
这个问题其实相当棘手,因为据我们了解的情况,目前市面上还没有一个试剂生产厂家有这样「完美」固定试剂可以先固定样本而不对后续染色产生任何影响,如果有的话,那我们今天所说的关于固定的问题,都不算是问题。
在实际遇到预固定和指标不兼容时,我们会做如下建议:(1)使用替代指标来更换那些受固定影响的指标;(2)如果没有可以替代指标,请根据实验重要性原则来取舍检测指标,比如是磷酸化的指标会比表面的指标更为重要。虽然这一段看起来有一点像「废话」,但我们需要在实际实验过程中学会做取舍和判断。
4. 结语
流式实验中会碰到很多有意思的问题,小达君后续会慢慢进行整理,并和大家做分享交流,也希望大家多与我们分享宝贵的经验,共同提高!
参考文献:
[1] Cossarizza A, Chang HD, Radbruch A, et al.Guidelines for the use of flow cytometry and cell sorting in immunologicalstudies. Eur J Immunol. 2017 Oct; 47(10):1584 – 1797.
[2] Li N, HalldeÂn G, Hjemdahl P. A whole-blood flow cytometric assay for leukocyte CD11b expression using fluorescencesignal triggering. Eur J Haematol. 2000: 65:57±65.
[3] Judith C. Stewart, Michelle L. Villasmil andMark W. Frampton. Changes in Fluorescence Intensity of Selected LeukocyteSurface Markers Following Fixation. Cytometry A. 2007 Jun;71(6):379 – 85.