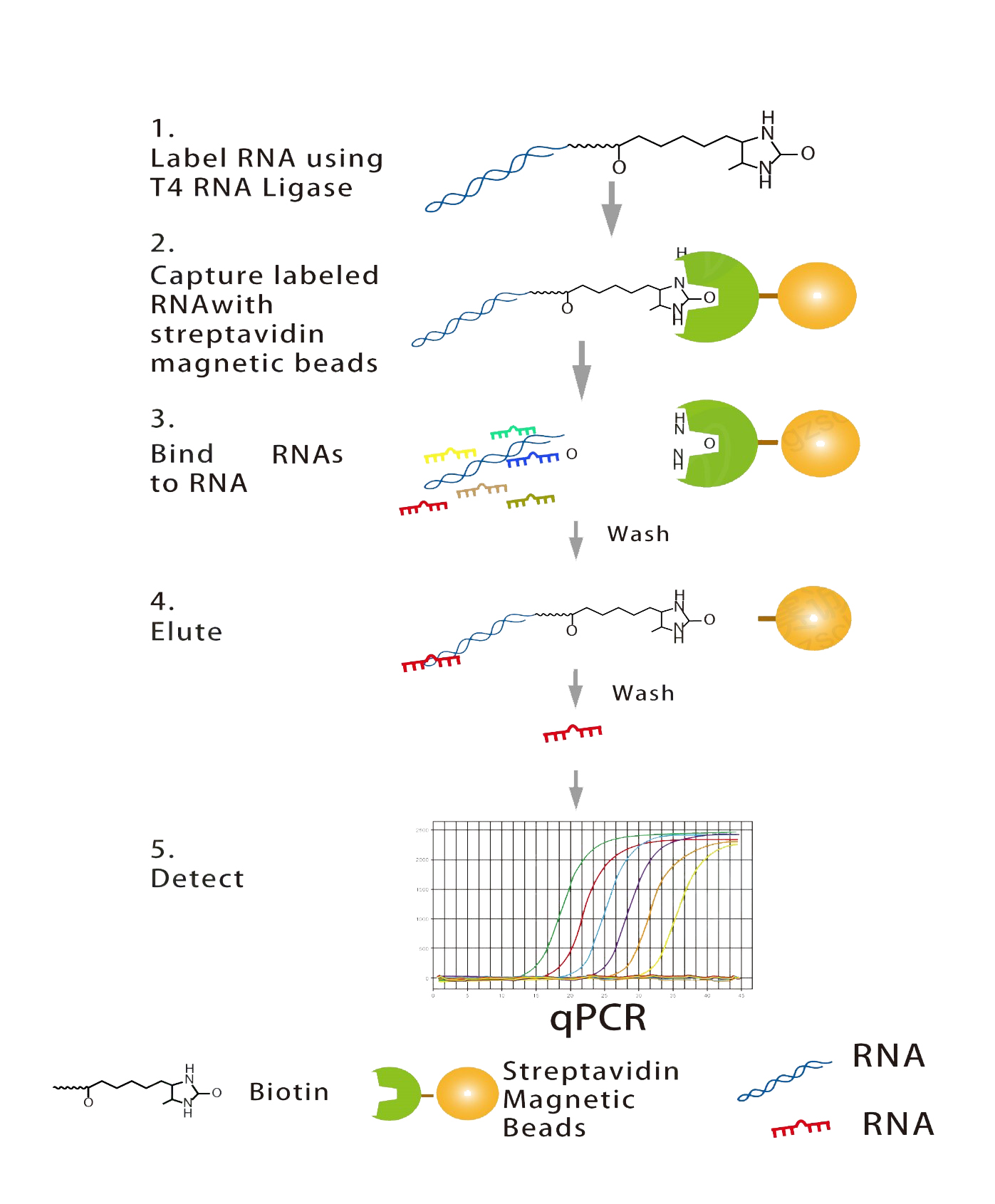
RNA-RNA pull-down是检测RNA与其靶RNA之间相互作用的主要实验手段之一。RNA-RNA pull-down使用体外转录法标记生物素RNA探针,然后与胞浆提取液孵育,形成RNA-RNA复合物。该复合物可与链亲和素标记的磁珠结合,从而与孵育液中的其他成分分离。复合物洗脱后,通过qRT-PCR实验检测特定的RNA是否与靶标RNA相互作用。
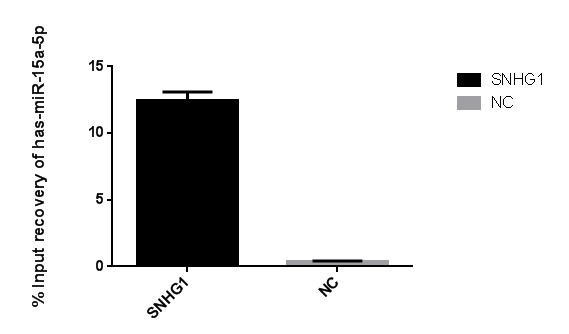
RNA-RNA pull-down实验结果为RNA产物的测序或qPCR结果,下图为qPCR结果示例:
材料和试剂
- 10 cm 组织培养皿
- 1.5 ml 离心管
- PCR管
- 15 和 50 ml离心管
- qPCR板
- 细胞
- 3’BIOTIN 标记合成的miRNA 序列
- 磷酸盐缓冲盐水 (PBS)
- 蛋白酶抑制剂(100x)
- RNase 抑制剂
- 链霉亲和素-Dyna 珠(Dynabeads™ M-280 Streptavidin)(Thermo Fisher Scientific,Invitrogen TM,目录号:11205D )
- 酵母 tRNA(原液 10 mg/ml,作为杂交封堵剂,保护探针)
- TRIzol(Thermo Fisher Scientific,Ambion TM )
- 氯仿
- 异丙醇
- GlycoBlue TM共沉淀剂
- 200 proof纯酒精(Sigma-Aldrich,目录号:E7023)
- 无核酸酶水
- 逆转录系统(Promega,目录号:A3500)
- Micro RNA RT 试剂盒(Thermo Fisher Scientific,Applied Biosystem TM)
- miRNeasy Mini Kit(QIAGEN,目录号: 217004 )
- Qiashredder(QIAGEN,目录号: 79656 )
- RNAiMax(Thermo Fisher Scientific,Invitrogen TM,目录号:13778150 )
- 氯化钾 (KCl)
- 氯化镁 (MgCl 2 )
- Tris-盐酸盐(pH 7.5)
- IGEPAL CA-630(Sigma-Aldrich,目录号:I8896)
- 氢氧化钠 (NaOH)
- 氯化钠 (NaCl)
- 裂解缓冲液(见配方)
- 溶液 A(见配方)
- 溶液 B(见配方)
设备
- 磁力架
- 迷你管旋转器
- 冷冻离心机
- ABI Step one plus Q-PCR 系统(
- 96孔PCR仪
- -20°C 冰箱
- 涡旋器
步骤
合成在 3′ 末端用生物素标记的目标 miRNA 和对照 miRNA。在转染前一天将细胞接种在 10 cm 组织培养皿中,一式两份。24h后,用对照 miRNA 和 3′ 生物素标记的 miRNA 转染细胞,最终浓度为 10-100 nM。根据转染试剂制造商的指南进行转染。转染后48h,收获全细胞裂解物。(时间和浓度需要优化,因为它随细胞系和 miRNA 变化)。转染后一天可以更换培养基。
- 细胞裂解液制备
- 从培养皿中吸出培养基,用冰冷的 1x PBS 仔细清洗细胞两次。刮去或胰蛋白酶消化细胞,在 4°C 下以 2,000 xg旋转5 min。收集沉淀前预冷微量离心管。
注意:此时细胞沉淀可以储存在-80°C。 - 如果继续使用裂解液,则添加 550 μl 裂解缓冲液,并补充蛋白酶抑制剂 (PI) 和 RNase 抑制剂。(始终在裂解时添加 PI 和 RNase 抑制剂)。轻轻吹打将细胞与裂解缓冲液混合。在冰上孵育 10 min。将细胞裂解物在 4°C、14000rpm 下离心10 min。将上清液收集到新的微量离心管中。
- 同时,准备链霉亲和素-Dyna 珠(每个样品 50 μl)。
- 用 500 μl 溶液 A 清洗珠子两次。
- 用 500 μl 溶液 B 清洗珠子两次。
- 用 1 ml 裂解缓冲液清洗珠子 3 次。在每次洗涤时,将管子放在磁力架上,小心地取出上清液,不要取出珠子。
- 用 500 μl 裂解缓冲液和 10 μl 酵母 tRNA 在旋转器上在 4°C 下孵育珠子 2h。
- 从培养皿中吸出培养基,用冰冷的 1x PBS 仔细清洗细胞两次。刮去或胰蛋白酶消化细胞,在 4°C 下以 2,000 xg旋转5 min。收集沉淀前预冷微量离心管。
- Pull down
- 孵育 2 h后,将装有珠子的管子放在磁力架上,取出上清液,用 1 ml 裂解缓冲液清洗珠子一次。
- 将 500 μl 裂解物与珠子混合,并在 4°C 下在旋转器上孵育过夜。在 -80 °C 保存超过 50 μl 裂解液,用作input。
- 第二天,将管短暂离心并将其放在磁力架上并去除上清液。用 1 ml 裂解缓冲液清洗珠子 4 次。
- RNA分离
- 从-80°C 取出保存的裂解物,在冰上解冻。
- 将 750 μl Trizol和 250 μl 水添加到每个样品的输入和下拉的磁珠中并混合均匀。将管子放在 -20°C 的冰箱中至少 2 h(管子可以保持在-20°C 过夜)。
- 在室温下解冻混合物,加入 200 μl 氯仿,涡旋 45 秒,并在室温下保持 2-3 min。
- 在 4 °C 下以 12000rpm 离心15 min。
注意:提前打开离心机,以便在管子准备好旋转时它已经在 4°C。 - 将上层转移到新管中(大约为 500-600 μl)。丢弃旧管。
- 加入等体积的异丙醇和 5 μl 糖蓝,颠倒试管数次混合。在 RT 中孵育 10 min。
- 在 4 °C 下以12000rpm 离心15 min。非常小心地丢弃上清液。用 1 ml 预冷的 70% 乙醇洗涤沉淀两次。
- 洗涤时小心去除上清液。风干沉淀并将其重悬于 20 μl 无核酸酶水中。
- 逆转录聚合酶链反应
- 使用来自生物素标记样品的 20 μl RNA 和来自input样品的 1 μg RNA 用于 mRNA RT 反应。根据制造商的说明设置 mRNA RT 反应。
- 使用 TaqMan miRNA 逆转录试剂盒和input样品的特定 miRNA 引物,每 15 μl 反应,使用 10 ng 总 RNA。
- 使用 mRNA-RT Kit 制备的 cDNA 对目标 mRNA 进行三次重复的 q-PCR。cDNA 的体积需要优化,因为目标的结合能力会有所不同。如果可能,请包括阳性对照(特定 miRNA 的已知靶标)。GAPDH 可用作内参。
- 对于miRNA 水平,使用miRNA cDNA 一式三份运行单独的 q-PCR。U6 可用于上样控制。
数据分析
计算 miRNA 富集如下:
目的miRNA下拉样本中mRNA的Ct值/对照miRNA下拉样本中mRNA的Ct值= X
目的miRNAinput样本中mRNA的Ct值/对照miRNAinput样本中mRNA的Ct值 = Y
Fold binding = X/Y。
结果表示为三个独立实验的平均值±标准差,每组实验至少重复三次。来自多次测定的数据进行双尾t检验,P值 < 0.05 被认为具有统计学意义。
配方
- 裂解缓冲液
20 mM Tris-HCl (pH 7.5)
100 mM KCl
5 mM MgCl 2
0.3% IGEPAL CA-630 - 溶液 A
0.1 M NaOH
0.05 M NaCl - 溶液 B
0.1 M NaCl
70% 乙醇
用 200 标准 100% 乙醇中的无核酸酶水稀释并在使用前预冷
原文见下一页
Pages: 1 2
你好,请问“用 200 标准 100% 乙醇中的无核酸酶水稀释并在使用前预冷”是什么意思