无论原发性肿瘤还是继发性肿瘤,一旦生长直径超过1~2 mm,都会有血管生成。这是由于肿瘤细胞自身可分泌多种生长因子,诱导血管生成。多数恶性肿瘤的血管生成密集且生长迅速。因此,血管生成在肿瘤的发展转移过程中起到重要作用,抑制这一过程将能明显阻止肿瘤组织的发展和扩散转移。
体外的血管生成实验能很好的模拟肿瘤的血管发生过程,并且适合研究药物对这一过程的影响实验。我们以HUVEC细胞为例,介绍这一实验的详细过程。
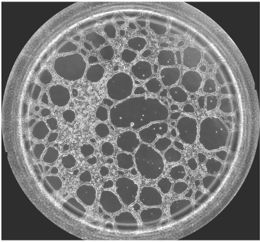
图一 血管生成镜检图
一. 实验材料和实验方法
1. 实验材料

2. 实验方法:
2.1 实验流程介绍
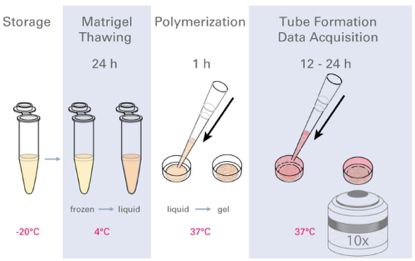
图二 实验流程图
(提前将Matrigel融化,铺于ibidi血管生成载玻片的下孔中,待胶凝后,将细胞悬液加入血管生成载玻片上孔中,成管后使用显微镜观察。)
2.2 耗材结构介绍
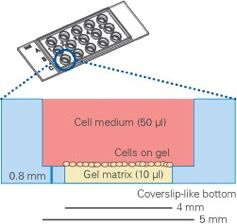
图三 血管生成载玻片纵截面示意图
(Matrigel铺在下孔,细胞铺在Matrigel上,上孔充满培养基)
2.3 数据分析流程介绍
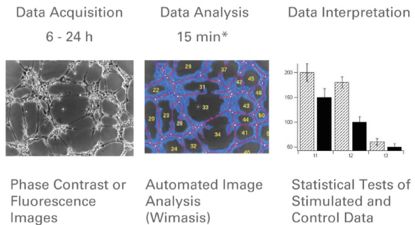
图四 实验结果收集和分析流程图
(在特定的时间点采集图片,并且进行图像分析(Wimasis全自动分析)测量小管长度,成环数,细胞覆盖面积和结点。之后在对测量结果进行统计分析以说明实验结果。)
二. 实验步骤
1. 准备基质胶
1).实验前一天将Matrigel置于冰盒中,放入4。C冰箱,使胶能过夜缓慢融化。(注意:同样要准备一些4。C预冷的枪头用于吸取Matrigel)
2).开始实验前,将Matrigel始终保持放在冰盒中。
3).打开灭菌包装,取出ibidi血管生成载玻片。
4).每孔中加入10μl Matrigel。注意枪头要垂直于内孔的正上方加入Matrigel,防止有Matrigel流经上孔而留下残留胶。

由于Matrigel流动性不强,并且有可能移液枪不准确,有可能打入10μl的胶,却不能填满血管生成载玻片的下孔——这样,必然会影响到实验的成像结果。
如何判断是否加入了合适体积的Matrigel:
我们只需用一张格子纸就能知道自己的移液枪调整到多少能正好把下孔填满。

如上图所示,垂直透过每个孔看下面的格子纸,如果格子被缩小了,那么就说明胶没加满,格子被放大了,那么胶就加多了,格子没发生什么变形,这才是刚刚加满下孔的状态。
2. 凝胶
1).盖上ibidi血管生成载玻片的盖子。
2).准备一个10cm的培养皿,放入浸过水的纸巾,制成一个湿盒。
3).将ibidi血管生成载玻片放入培养皿中,盖上培养皿盖。
4).将整个培养皿放入培养箱中,静置30分钟左右,等待胶凝结。
5).等待同时准备细胞悬液。

3. 铺细胞
加入细胞的量直接影响实验结果,所以在正式实验开始之前,要对不同类型的细胞和使用数量进行预实验。获得最佳比例的细胞密度。我们今天的实验使用HUVEC细胞,每孔种10000个细胞即可。
1).准备密度为2*105cells/ml的细胞悬液,充分混匀。
2).将胶已经凝固的ibidi血管生成载玻片从湿盒中取出。
3).每孔加入50μl的细胞悬液,注意保持枪头垂直在上孔的上方,不要接触下孔的凝胶。可以使用排枪。
4).同样用格子纸查看是不是加了足够量的液体,如果没有,加入无细胞的培养基,使上孔液体正好加满。
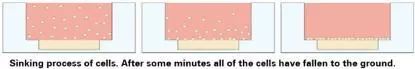
5).盖上盖,静置,一段时间后,所有细胞都会沉下去落在Matrigel的表面。
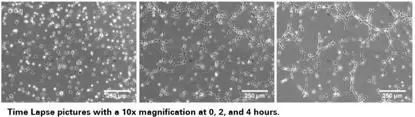
4. 采集图像并统计结果
可以按照细胞的生长速度定时采集图像,并且对其成管长度,覆盖面积,成环数,结点数进行测量和记录,并且对其进行统计分析。
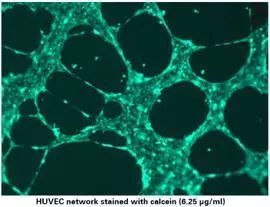
5. 免疫荧光染色
根据需要,可以对成管结果进行免疫荧光染色。
1).小心的移除上孔内培养基,注意不要碰到胶或者细胞网络。
2).加入50μl用无血清培养基稀释的calcein (12.5 µl calcein stock 1 µg/µl),使其终浓度为 6.25 µg/ml (1:160)。
3).在室温下避光孵育30分钟。
4).使用PBS清洗三次,注意,PBS要缓缓加入上孔,以免冲击掉细胞。
5).使用 485 nm/ 529 nm进行免疫荧光成像。
实验优势
1.此实验方法能节省更多基质胶,降低实验成本;
2.分上下孔的ibidi血管生成载玻片能去除凹液面,使成像效果更好。
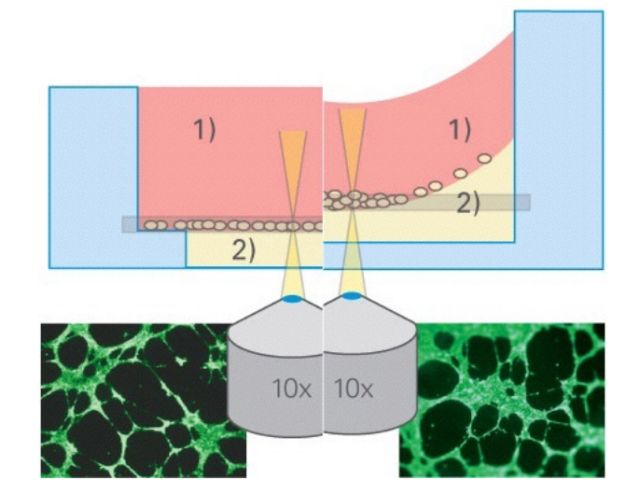
(左侧ibidi血管生成载玻片无凹液面,整个视野成像清晰;右侧96孔板有凹液面,中间清晰周围模糊。)