泛素化降解蛋白质需要通过泛素化蛋白酶体来实现,蛋白酶体存在于细胞质和细胞核,是一种由十到二十个亚基组成的蛋白复合物。在生物细胞体内普遍存在的是26s蛋白酶体,它的组成分为两部分,一部分是20s蛋白酶体,是核心的成分,另一部分是两个19s蛋白酶体,起调节作用。细胞内的大部分蛋白质都是由26s蛋白酶体降解的。靶蛋白的泛素化降解是经过几个连续的过程来完成的:
① 在ATP供给能量的情况下,泛素激活酶E1将泛素分子活化;
② 泛素激活酶E1将活化的泛素分子传递给泛素结合酶E2;
③ 泛素连接酶E3将结合E2的泛素连接到靶蛋白上。
④ 26s蛋白酶体特异性地识别这个带有泛素标签的底物蛋白,将其降解掉。
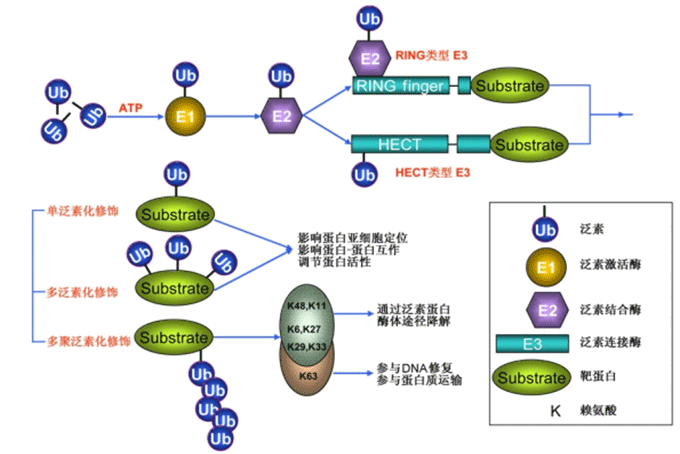
总的来说,靶蛋白是在泛素激活酶E1、泛素结合酶E2、泛素连接酶E3的依次作用下共价连接上几个泛素分子,最后被26s蛋白酶体特异性地识别并降解成小肽,泛素在去泛素连接酶的作用下进行回收利用,这些小肽再被细胞质中的蛋白酶降解为氨基酸。
泛素化修饰分为单泛素化修饰和多聚泛素化修饰,多聚泛素化修饰包括K6、K11、K27、k29、k33、k48、k63位的修饰,其中k48、k63位的研究比较多,k48位的多聚泛素化修饰主要起降解和调控蛋白稳定性的作用,k63位的作用主要是信号转导、DNA修复和调控蛋白的活性。
泛素化异常介导的病理过程
1、泛素化异常与恶性肿瘤
目前泛素化异常主要是通过三条途径引发恶性肿瘤的发生:
1)调控细胞周期蛋白的稳定性。泛素化异常可致使细胞周期相关蛋白表达紊乱和细胞周期失控,最终导致细胞癌变;
2)调控肿瘤抑制因子的表达。当泛素-蛋白酶体系过度激活时,p53蛋白会被过度泛素化降解,表达量过低,则无法起到抑癌基因的作用;
3)参与调控多条关键的信号通路。泛素化异常可导致信号通路发生异常,致使细胞癌变。
2、泛素化异常与神经退行性疾病
异常蛋白的积聚和沉积(如阿尔茨海默病的tau蛋白和β-淀粉样蛋白)是神经退行性疾病的共同病理机制,而已有研究证明泛素化异常可能是导致神经退行性疾病的主要原因。因而激活蛋白酶体、增强其对错误折叠蛋白质的降解能力,已经成为治疗神经退行性疾病的一种可能的方法。
基于泛素化的药物研发
因此,近年来泛素化过程已经逐渐成为了肿瘤的治疗靶点,因而泛素-蛋白酶体系统中的关键组分开发相应的抑制剂在临床上具有重要的意义。
1)针对泛素蛋白连接酶E3的药物
因泛素蛋白连接酶E3能够特异性识别待降解的底物,因此,目前针对E3酶的药物研发是整个泛素化过程中最为受到关注的领域。
在人类基因组的众多E3酶中,以MDM2、E6AP、SKP2、Nedd4和Fbw7为基础的研究最为常见。
MDM2能促进p53蛋白的泛素化降解,可阻断由p53介导的细胞周期阻滞或细胞凋亡。第一个以E3酶MDM2为靶点的小分子抑制剂Nutlin则首先被研发出来,但Nutlin对含有突变型p53的肿瘤细胞往往效果不佳。
SKP2可识别并泛素化降解很多的肿瘤抑制因子,如p21、p27、钙粘蛋白(cadherin)、FOXO1,诱导细胞发生癌变。
在以SKP2为靶点的抑制剂中,Cpd A可通过阻止SKP2进入SCF(Skp1-Cul1-F-box) E3酶复合物,并抑制SCF复合物的功能,能引发肿瘤细胞的G1/S期细胞周期阻滞和诱导肿瘤细胞发生凋亡。
另一种抑制剂SMIP0004则能下调SKP2的表达水平,从而诱导前列腺癌细胞G1期细胞周期阻滞,抑制细胞的增殖和集落的生成。
2)针对蛋白酶体的药物
用蛋白酶体抑制剂处理肿瘤细胞,可打破肿瘤细胞内部促凋亡蛋白和抗凋亡蛋白之间的平衡,诱发肿瘤细胞的周期阻滞和细胞凋亡现象。因此,蛋白酶体抑制剂被认为是克服化疗增敏、遏制肿瘤细胞扩散的有效靶点。
目前,第一代蛋白酶体抑制剂硼替佐米(Bortezomib)和第二代蛋白酶体抑制剂卡非佐米(Carfilzomib)在治疗多发性骨髓瘤和淋巴瘤等方面已有不错的疗效。
泛素化研究的实验手段
1)生物信息学分析
目前关于蛋白的泛素化修饰,数据收录最为齐全的是Uniprot数据库,它会根据发表的文献收录蛋白翻译后修饰相关的信息,以供网友们查询。
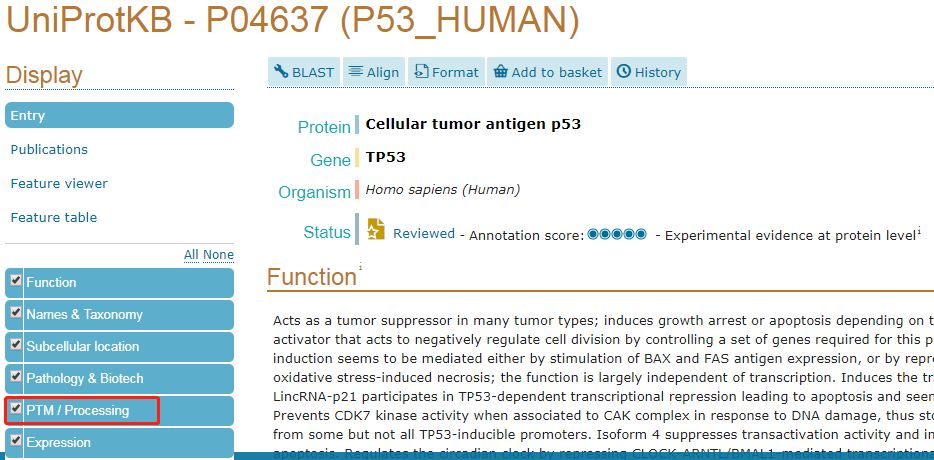
点击“PTM/Processing”就可显示出所有文献中报道的和p53相关的翻译后修饰的类型和发生修饰的位点以及相应的文献。
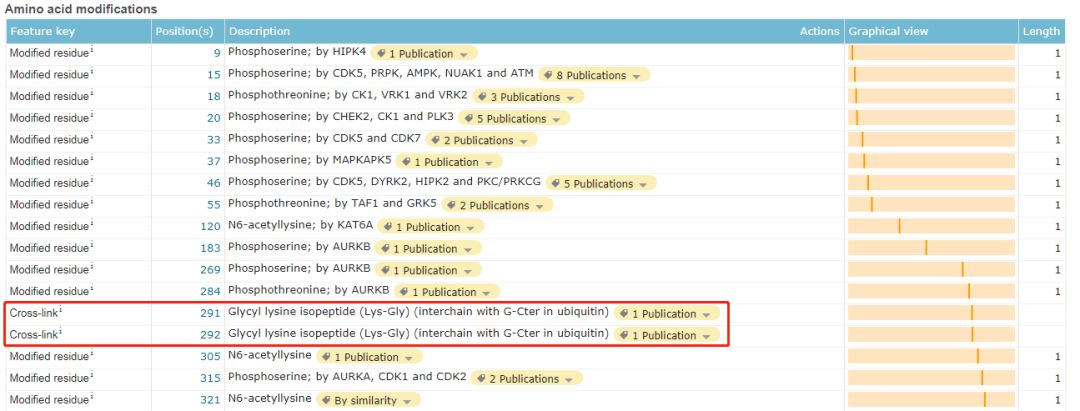
显然,对于p53而言,发生泛素化的位点有两处:291位和292位。如果想要深入了解相关信息,可以点击旁边的publication按钮即可。
然而Uniprot数据库并不是一个专门只收集蛋白泛素化信息的数据库,因此Uniprot数据库在泛素化信息收集的专业性方面还存在诸多的不足。除了Uniprot数据库之外,还有一些专门收集蛋白泛素化信息的数据库:UbiProt、E3Net和 hUbiquitome。
UbiProt 是一个收录泛素化修饰底物蛋白的数据库。其中每个数据条目都是通过人工手动的方式进行提取并注释的,描述了特定的泛素化底物蛋白信息,如蛋白的性质、物种来源、泛素化修饰特征、参考文献及相关链接等。其数据来源于一些大规模组学实验数据,而其余的底物蛋白数据是从针对特定蛋白的泛素化修饰实验研究中得到的。

E3Net数据库是当前泛素化修饰相关蛋白数据库中最为出色的,共收录了427个物种中2201个泛素化修饰E3及4896个底物蛋白信息,其中包含493个E3与1277个底物蛋白之间的1671个特异选择关系。该数据库的数据来源主要是文本挖掘方法挖掘MEDLINE摘要得到的结果、UniProt相关条目注释信息、公共泛素化数据库收录数据以及高通量实验数据。

hUbiquitome旨在收录高可信度的实验验证的人类泛素化相关蛋白质,共收录了1个E1、12个E2、138个E3、279个底物蛋白以及17个去泛素化酶。该数据库规模较小,但可信度较高,由于收录的全部为实验验证的数据,且为人工手动录入,提高了数据库所收录数据的可靠性。

2)泛素化的实验研究
通过高通量手段进行泛素化蛋白的检测。先提取蛋白样本后进行胰酶酶解,随后进行HPLC分级。再利用可以结合并纯化泛素化底物的抗体,富集所有被泛素化标记的蛋白片段。最后进行质谱分析、数据处理和生物信息学分析。此方法都是由专业的公司来完成的。
鉴定E3泛素蛋白连接酶。因只有E3泛素蛋白连接酶才具有底物识别的特异性,则在研究底物的泛素化过程时,找到并且验证E3酶是最为重要的工作。
而要验证底物和E3泛素蛋白连接酶之间的关系,至少需要证明两个方面:1.通过Co-IP或者酵母双杂交验证E3酶和底物之间能够相互结合;
2.采用体外泛素化实验(In vitro ubiquitination assay)验证E3酶能介导底物的泛素化。即在体外将E1 酶、E2 酶、E3 酶、底物和标签标记(Myc tag和His tag)的泛素分子混合后并进行孵育,再通过SDS-PAGE以及标签蛋白的抗体(myc抗体或者His抗体)来检测被泛素化标记的底物分子。
又因底物可被单个或多个泛素标记,而且底物上的泛素链长度有长有短,并不均一。因此通过标签抗体检测到的底物分子,往往呈现出一片smear 的形态(如图3)。
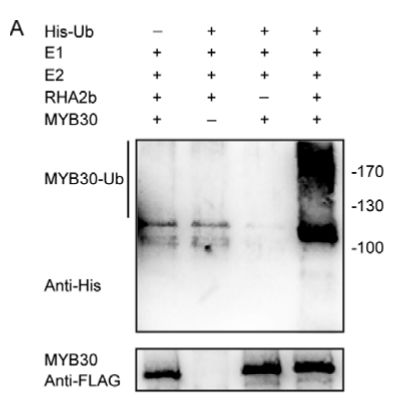
图3:E3 酶介导底物泛素化的典型western 结果图。图中RHA2b是E3 酶,MYB30是底物分子。