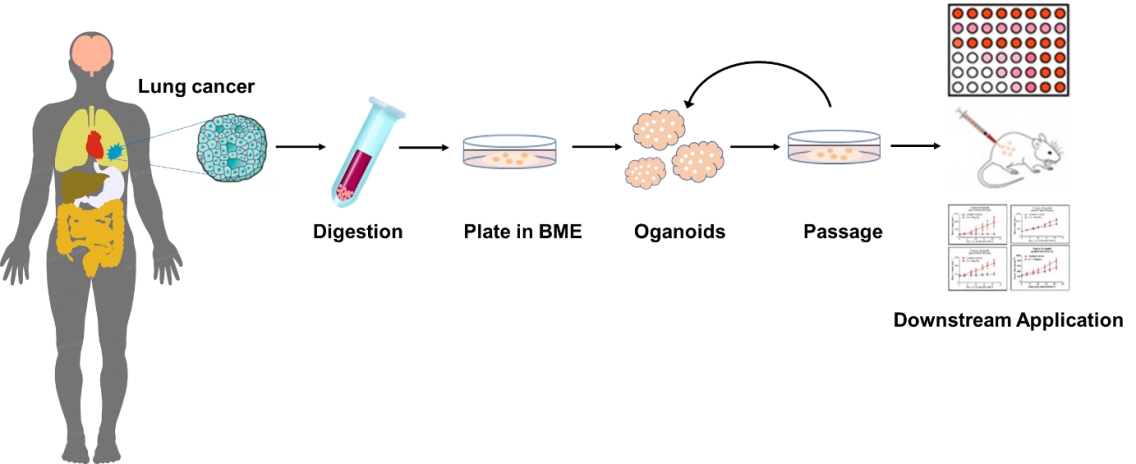
肺癌是我国发病率和死亡率最高的肿瘤。肺癌在不同个体之间体现出的巨大异质性体现在其临床特征、组织学特征、多组学检测,以及药物敏感性的差异上,因此肺癌的全程管理需要依靠精准医学的手段来实现。肿瘤类器官(patient-derived organoids, PDO) 模型的应用,在肺癌现有的以病理和基因等多组学检测结果为基础的精准医学决策体系之外,增加了从体外功能学模型角度出发的决策因素,弥补了病理指导下的难治性肺癌的治疗方案不足。
一、肺肿瘤组织分离消化
1)组织消化工作液的配制
本方法采用 Cellada-TD-001 原代组织消化液。在实验前,按照说明书要求配制组织的分离消化液。组织消化液主要含有胶原酶 I 型和 IV 型,浓度为 400-1000 U/mL,添加核酸酶 5-20 U/mL,以及 10μM ROCK 抑制剂可以提高生长效率。
2)组织清洗
在超净台内,将组织从原代组织保存液中取出,放置入 100 mm 无菌培养皿中,用含有双抗的 PBS 抽吸冲洗 3 次。
3)组织的机械分离
采用无菌的剪刀和手术刀,对标本进行机械分离,将大块的组织分离成为大约 1 mm3 的细小碎片或糊糜状。
4)组织消化
将经过机械消化的组织,完全转移进入 15 ml 无菌离心管中,根据组织量,按照 1:4 的体积比,添加适量组织消化液,用 1 ml 枪头轻轻吹打组织,使其充分分散;将含有该消化液的离心管放置恒温空气浴的摇床上,于 37℃ 下,120rpm,消化分离 30 min。中间每个 5 min 取出,镜下观察分离效果,至大部分组织分离消化后停止,用无菌的 PBS 进行终止消化。
细胞悬液用 100μm 的筛网进行过滤,将细胞悬液过滤进入新的 15 ml 离心管中,用无菌 PBS 清洗筛网。
5)细胞洗涤
将上述含有细胞滤液的离心管在 4℃,1200 g,离心 5 min,小心去除上清。沉淀细胞用 PBS 清洗一次;向细胞沉淀中加入适量的细胞培养液,轻轻吹打制成单细胞悬液,4℃,1200 g,离心 5 min。
二、肺癌类器官培养
6) 试剂耗材的准备
实验前将人肺组织类器官分离培养液(Cellada-LO-001)和 PBS 放置室温预热;将 Corning 24 孔低吸附培养提前放置 37℃ 预热;板将 BME(推荐 R&D Systems Cultrex RGF, BME2) 放置 4℃ 冰箱融化过夜,与 BME 接触的枪头放置-20℃ 冷冻 1 小时。
7) 肺癌类器官种板
吸出上述步骤 5)上清液,将沉淀重悬在 BME 中,BME 置于冰上,防止凝固。BME 的用量取决于细胞沉淀的量,大约 10000 个细胞,接种在 50-60μL 的 BME2 中。将类器官和 BME2 的混合物滴在预热的 24 孔低吸附培养板底部,每滴 50μL,每孔 1 滴。
将培养板放置于 37℃,CO2 培养箱,孵育 30 min,待胶体凝固后,将培养板取出,加入预热的人肺组织类器官分离培养液。
8) 肺癌类器官培养
2-3 天后根据类器官生长形态,更换人肺癌组织类器官培养液(Cellada-LCO-001)。
9) 类器官观察
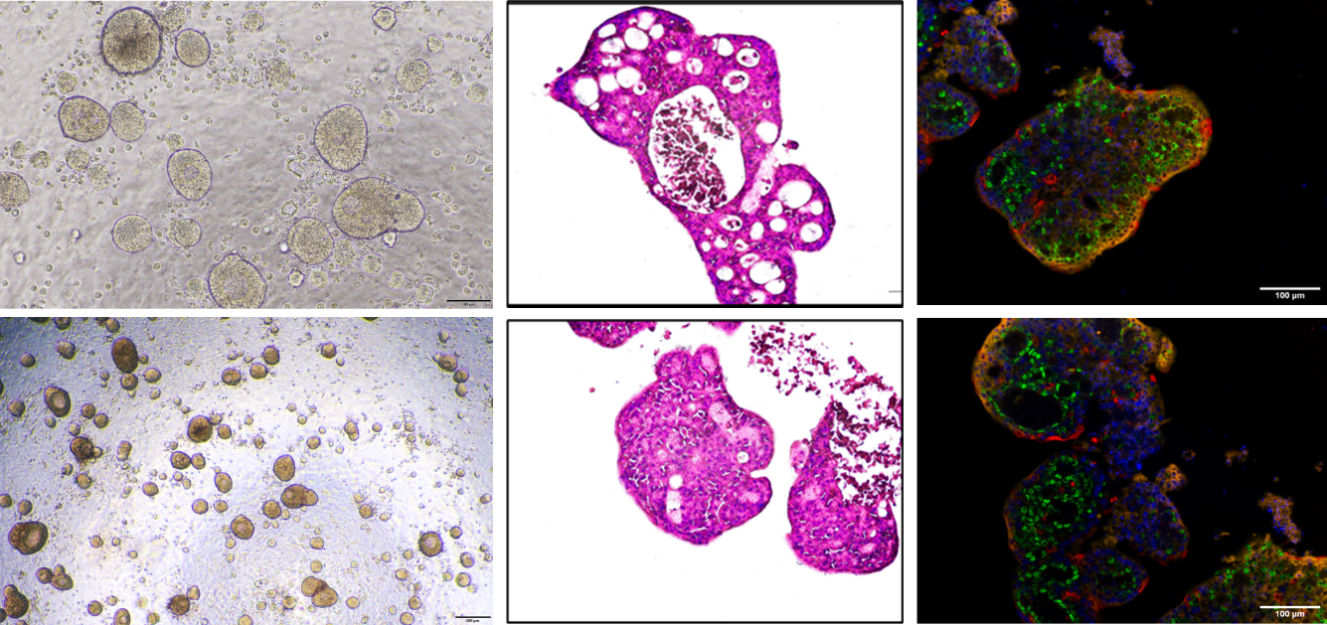
每天观察类器官并拍照,了解初始类器官数量、增殖速度、形态、微生物污染情况等。
参考文献
1. Sachs N., Papaspyropoulos A., Zomer‐van Ommen, et al. Long‐term expanding human airway organoids for disease modeling. EMBO J, 2019, 38(4): e100300.
2. Kim M., Mun H., Sung C, et al. Patient-derived lung cancer organoids as in vitro cancer models for therapeutic screening. Nat Commun., 2019, 10(1): 3991.
3. Shi R., Radulovich N., N C., et al. Organoid cultures as preclinical models of non-small cell lung cancer. Clin Cancer Res., 2020, 26(5):1162-1174.