DNA损伤是指DNA结构或碱基配对的部位发生损伤。伤害最大的损伤类型是两条DNA链的断裂- -双链断裂(double-strand break,DSB),因此DSB的修复对基因组的稳定性至关重要。DSBs可以由核酸酶和活性氧等细胞内因素引起,也可以由电离辐射和紫外光等外力因素引起;然而,这些类型的损伤是随机发生且不可预测的。为了对DNA断裂的位置进行一定的控制,研究人员设计了基于质粒的系统,可以在指定的位置靶向和切割DNA。不管是什么原因导致的DSB,修复机制的作用是相同的。
为此,下面将描述同源定向修复的一般机制,重点是修复在实验室中以基因组修饰为目的而设计的断裂。
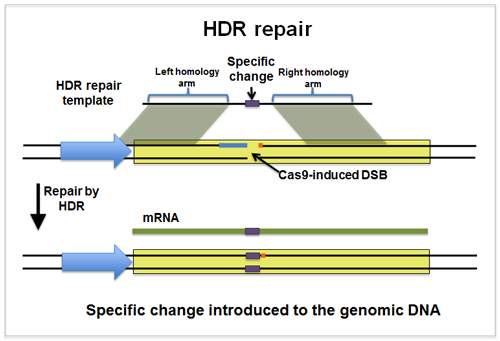
一、同源定向修复是如何修复双链断裂的?
基因组的稳定需要正确、高效地修复DSBs。在真核细胞中,DSBs的修复机制主要通过两条途径进行的:
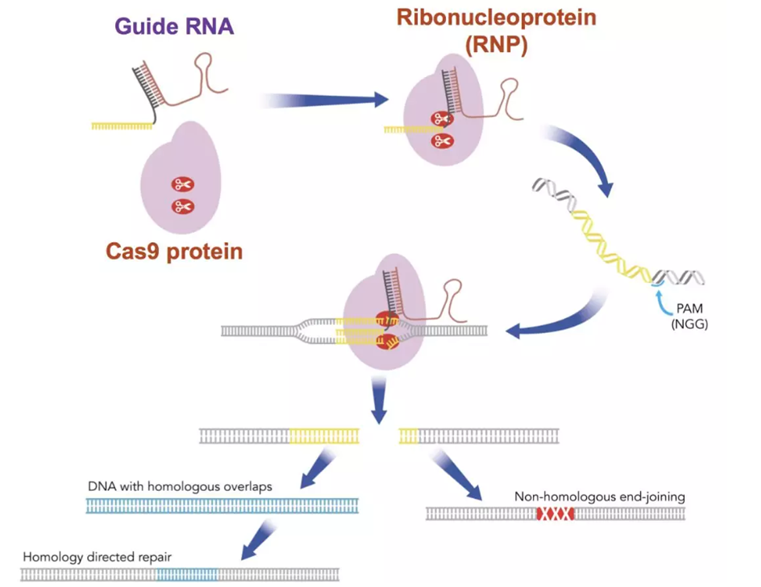
非同源末端连接(Non-Homologous End-Joining,NHEJ)和同源定向修复(Homology Directed Repair,HDR)。NHEJ是经典的同源性非依赖性途径,因为它只涉及一个到几个互补碱基的排列,用于两端的重新连接,而HDR则使用较长的同源性序列来修复DNA损伤。
下面将主要描述HDR,由于要求DNA受损链和完整的供体链之间具有更高的序列同源性,因此HDR是DSB修复更精确的机制。如果用于修复的DNA模板与DSB处的原始DNA序列完全相同,那么这个过程不会错配。或者如果模板 DNA 中存在这些修饰,则可以将特定突变引入受损的 DNA 中。
有几种独特的 HDR 机制,但所有模板化修复途径都有以下核心步骤:
- 断裂的 5′ DNA 末端被核酸酶切除,以产生 ssDNA 3′ 突出端。这既可以作为链侵袭所需蛋白质的底物,也可以作为DNA修复合成的引物。
- 然后,ssDNA链取代同源DNA供体的一条链,并可以模板修复另一条链;这导致形成称为位移环(D环)的DNA结构。
- 然后,重组中间体可以解析以完成 DNA 修复过程
二、同源定向修复途径
HDR既可以非保守发生,也可以保守发生。非保守方法由单链退火(SSA)途径组成,更容易出错。以同源供体(例如姐妹染色单体、质粒等)精确修复DSB为特征的保守方法由三条途径组成:经典的双链断裂修复(classical double-strand break repair,DSBR)、合成依赖性链退火(synthesis-dependent strand-annealing,SDSA)和断裂诱导修复(break-induced repair,BIR)。
1. 经典的双链断裂修复(DSBR)
在经典的DSBR途径中,3’端引入一个完整的同源模板作为DNA修复合成的引物,最终导致double Holliday junctions(dHJs)的形成。dHJs是四分支结构,当引入链的延伸”捕获”并合成来自第二个DSB末端的DNA时形成。单个HJs通过两种方式之一的裂解来解决。观察上图中的左分支,每个连接可能发生在交叉链(水平方向为紫色箭头处)上,也可能发生在非交叉链(垂直方向为橙色箭头处)上。如果连接方法不同(例如,一个接头在交叉链上连接,另一个接头在非交叉链上连接),则会发生交叉事件;但是,如果两个HJ都以相同的方式连接,则会导致非交叉事件的发生。DSBR是半保守的,因为交叉事件是最常见的。
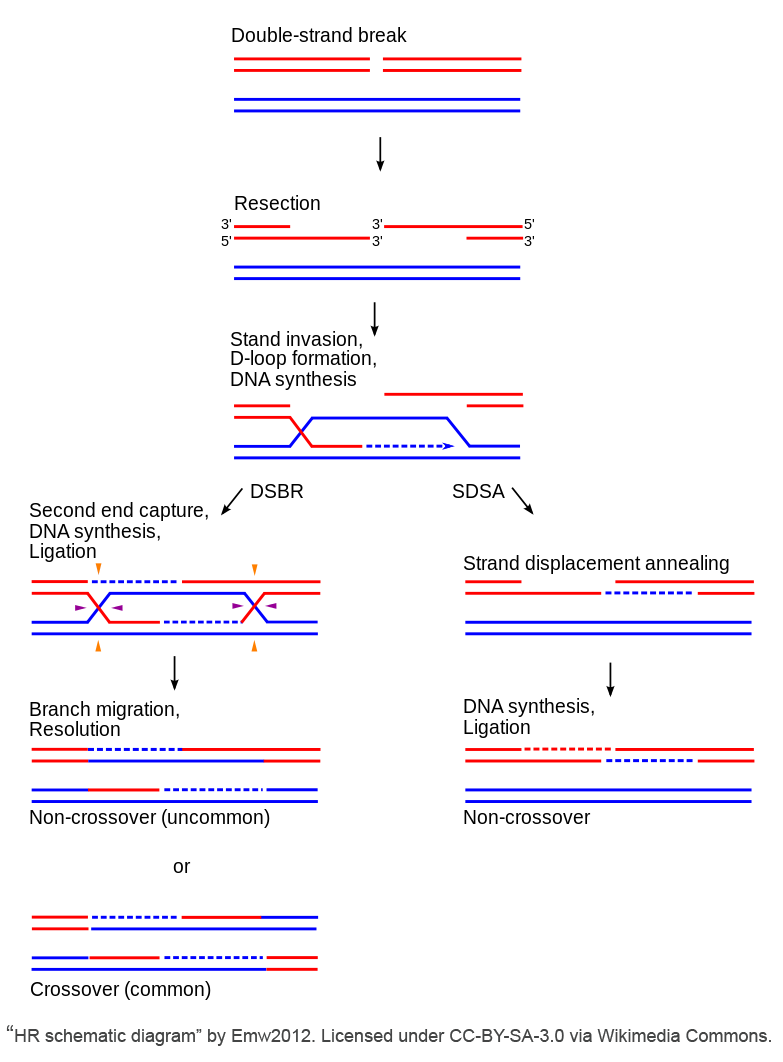
2. 合成依赖性链退火(Synthesis-dependent strand-annealing,SDSA)途径
如上图右分支所示,SDSA是保守的,并且只导致非交叉事件。这意味着所有新合成的序列都存在于同一个分子上。与DSBR不同的是,在SDSA中链引入和D环形成后,新合成的引入链部分从模板中被置换出来,并返回到DSB另一端的非引入链的加工端。非引入链的3 ‘端被拉长并连接以填补缺口,从而完成SDSA。
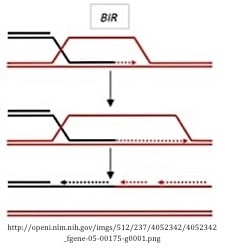
3. 断裂诱导修复(break-induced repair,BIR)途径
BIR的特征不如DSBR或SDSA,但这一途径的一个核心特征是在DSB中只存在一个可用于修复的引入性末端。这条引入性单链引入同源序列并同时启动前导链和滞后链的合成,从而导致一个HJ的形成。这个HJ是通过分裂交叉的链来解决的。虽然该途径可能不能立即应用于DSB诱导的基因打靶或与基于质粒的基因组工程相关,但它可能对修复没有第二个末端的染色体末端具有生物学意义,从而使DSBR或SDSA成为可能。
三、同源定向修复和基因组工程
基于质粒的方法诱导DSBs的同源重组已经用于基因组工程。锌指核酸酶(ZFNs)、TAL效应物核酸酶(TALENs)和CRISPR都可以指导核酸酶引起特定的DSB。操作简单、流程省时以及其目标的多功能性不仅重振了基因组工程,而且真正改变了该领域。
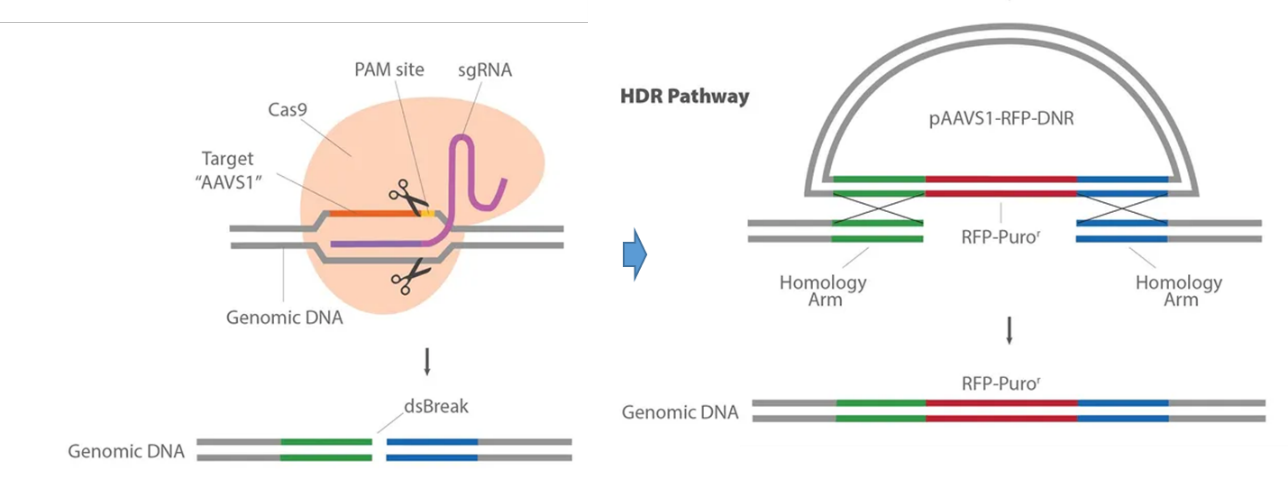
设计修复模板以产生突变的考虑因素
用于产生特定突变或将新元件插入到基因中的HDR模板需要与将被修饰的目标序列具有一定量的同源性。研究人员成功地使用了从CRISPR诱导的DSB开始的同源臂。一般来说,该修饰的插入位点应该非常靠近DSB,如果可能的话,最好小于10 bp。
值得注意的一点是,CRISPR酶可能会持续切割DNA,引入DSB并修复。只要gRNA靶位点/PAM位点保持完整,Cas9核酸内切酶就会不断切割修复DNA。如果你试图引入一个非常特殊的突变或序列,这种重复的编辑是不可靠的。为了解决这个问题,你应该设计HDR模板,最终在初始DSB修复后阻止进一步的Cas9靶向目标。阻断进一步编辑的两种方法是突变HDR模板中的PAM或gRNA序列。
最佳的修复模板是质粒DNA还是单链供体寡核苷酸(ssODN)?
在设计修复模板时,预期编辑的大小是一个很重要的因素,ssDNA模板(简称ssODNs)通常用于较小的修改。对于同源臂,小片段的插入/编辑可能只需要30-50个碱基,但请记住,这些数字可能会根据你的目的位点和实验系统而有所不同。常用的有50-80个碱基的同源臂。不对称同源臂(PAM远端36个碱基, PAM近端91个碱基)支持高达60 %的HDR效率(Corn等, 2016)。
由于构建长度大于200个碱基的ssODNs的难度较大,研究人员使用dsDNA质粒模板进行较大片段的插入,如荧光蛋白或筛选标记。这些模板应具有至少800bp的同源臂。质粒模板的HDR效率普遍较低;为了增加编辑的频率,研究人员设计了含有模板两侧gRNA靶位点的自切割质粒。当Cas酶和合适的gRNA 存在时,模板从载体上释放出来。为了避免质粒克隆,研究人员还使用PCR产生的长dsDNA模板,但这些模板可能具有细胞毒性,从而降低编辑效率。dsDNA模板的另一个缺点是能够直接整合到基因组中,复制同源臂序列。
Easi-CRISPR是一种允许研究人员利用ssODNs的优势进行较大突变的技术 (Quadros等, 2017)。为了创造大于200个碱基的ssODNs,可以在体外转录编码修复模板的RNA,然后使用逆转录酶来创造互补的ssDNA。Easi-CRISPR在小鼠敲入模型中效果良好,编辑效率从dsDNA的1-10 %提高到ssODNs的25-50 %。尽管不同基因位点和实验系统的HDR效率不同,但ssODN模板通常提供最高的HDR编辑频率。
减少NHEJ以促进HDR
为了促进HDR超过更常见的NHEJ修复机制,抑制NHEJ和激活HDR等策略已被使用。Rees等人和Nambiar等人利用Rad变体如Rad18 (Nambiar等,2019)和hRad51 (Rees等, 2019)等HDR因子激活HDR。抑制剂如CYREN可用于抑制NHEJ (Arnoult等,2017),而Cas9与显性负调控蛋白53BP1融合后既能抑制NHEJ又能激活HDR (Jayavaradhan等,2019)。
翻译自:CRISPR 101: Homology Directed Repair
https://blog.addgene.org/crispr-101-homology-directed-repair
其它参考:优化 CRISPR 敲入:成功敲入编辑的技巧和窍门