CRISPR-Cas9系统是目前最流行的基因组编辑技术,可以实现目的基因的敲除、插入和突变,该技术是一种由RNA指导Cas蛋白对靶基因定性修饰技术。科学家为了让Cas蛋白定向剪切DNA序列,在CRISPR工作机理的基础上,人为重组了一段目的基因的sgRNA(small-guide RNA),在sgRNA的引导下,Cas9蛋白可以实现对目的基因的定向切割。本文主要介绍,目的基因sgRNA设计和如何将sgRNA构建到CRISPR-Cas相关载体。
1. 目的基因sgRNA设计
目前设计sgRNA的网站比较多,张锋老师实验组总结了sgRNA设计工具如:https://zlab.bio/guide-design-resources,其中synthego(https://www.synthego.com/products/bioinformatics/crispr-design-tool)是小编比较喜欢用的设计工具。不过该网站只能设计人、果蝇和小鼠基因的sgRNA。以人的基因TP53为例,介绍TP53基因sgRNA的设计过程。
1.1 打开synthego网站sgRNA设计工具,点击Launch Design Tool
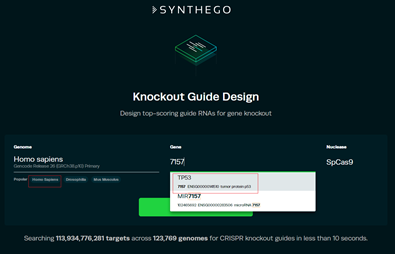
1.2 选择种属人Homo sapiens,人的TP53基因的ID号为7157,选择TP53基因,点击search;
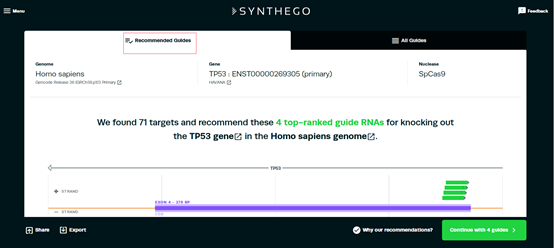
1.3 搜索结果分两部分:推荐的sgRNA和所有的sgRNA。往下滚动滚轮,会看到四条推荐的sgRNA的序列。
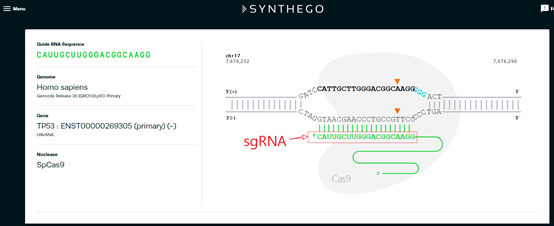
1.4 点击其中一条sgRNA序列,会看到sgRNA在TP53基因上的具体作用位置;
2. sgRNA重组构建
以lentiCRISPRv2载体为例,说明sgRNA是如果构建到该载体中。首先,将设计好的sgRNA中的U碱基改成T碱基,如TP53基因的sgRNA序列为5’-CAUUGCUUGGGACGGCAAGG-3’,修改后的碱基为5’-CATTGCTTGGGACGGCAAGG-3’,该序列的反向互补序列为3’-GTAACGAACCCTGCCGTTCC-5’。正向序列和反向互补序列退火成双链后就可以连接到载体中,但是需要在序列两端添加BsmBI酶切后的同源序列,如下图所示:
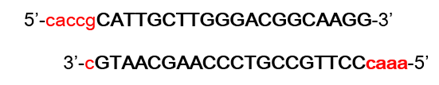
在生工生物合成这两条互补的序列后,退火成双链就可以连接到用BsmBI酶切后的LentiCRISPRv2载体中。sgRNA载体构建具体的操作过程如下。
2.1 LentiCRISPR载体酶切和去磷酸化,用BsmBI在37℃酶切30min;

2.2 琼脂糖凝胶纯化酶切的LentiCRISPRv2载体
LentiCRISPR载体的大小为14,873bp,酶切后产生两个片段,一条大的为目的片段,小片段大小为1885bp。在LentiCRISPRv2载体中有两个BsmBI酶切位点,两个位点之间的片段为1885bp,酶切连接后sgRNA正好在U6启动子下游,连接后的sgRNA下游就是gRNA scaffold序列,与sgRNA一起转录出来发挥gRNA的引导功能。
2.3 磷酸化和Oligo退火成双链DNA;

反应条件如下:37℃ 30min → 95℃ 5min,然后按照5℃/min降温到25℃。
生工生物可以提供磷酸化修饰的引物,可以选择在Oligo的5’磷酸化修饰,就不需要用T4 PNK磷酸化Oligo链了。
2.4 稀释退火的Oligo链;
上一步退火后的双链DNA,按照1:200用水稀释。
2.5 双链Oligo与酶切的载体连接(室温连接10min)

2.6 转化到Stbl3细菌;进行后续筛选。
您好,BsmBI酶切出来的载体两个粘性末端并不互补,不容易形成载体自连,请问为什么在构建的时候还需要对载体进行去磷酸化,对引物进行磷酸化修饰呢?
您好,你说的是对的,这个方法转自质粒开发者原文,这个步骤确实是不需要的
你好,请问同源重组的时候必须用BsmBI酶来酶切吗?
这个质粒是的,只能用这个
您好,请问磷酸化那步所用的试剂T4PNK有推荐的吗,10X T4 Ligation buffer是包含在商品化的T4PNK里面的吗
10X T4 Ligation buffer有的 我用的NEB的,单独包装的;
T4PNK磷酸化和后面的质粒去磷酸化其实讲道理可以不用,因为产生的粘性末端不一样,没有必要去磷酸化防止自连
要买的话其实随便一家就可以
您好!请问,得到的sgRNA的序列如果在反义链(antisense),那我在质粒上设计序列的时候应该把它放在正向序列上?还是反向序列上呢?另外,酶切位点暴露出的粘性末端是CACC,为什么要加上一个G变成CACCG呢?
不管你的sgRNA target哪个链,这与你构建治理没有关系,sgRNA是要在U6启动子下被转录出来,所以一定是要在正向上
加G的目的是因为U6启动子转录的偏好性,加一个G效率最高,当然如果sgRNA本身第一个碱基就是G,那就不需要,当然加了也没事
如果是不构建载体,直接将sgRNA体外转录,然后和Cass9蛋白一起电转进细胞还需不需要将sgRNA前面加一个碱基G呢?
体外转录是用的T7启动子,按照这个启动子的转录活性,一般启动子后面靶位序列连续带有3个G,转录效率最高。加不加取决于用的什么启动子 可以查一下对应启动子的偏好
您好,请问磷酸化和Oligo退火成双链DNA是可以一起做的吗?
可以哇 这个方法就是这样 我是follow这个方法 的
请问设计的物种不是常用物种怎么解决呀
一文掌握gRNA的设计,常用方法汇总解析
有几个网站是可以根据序列设计的,你试试看
请问有推荐吗
你好 推荐什么?我用的就是这个教程里的
您好。请问我的序列第一个碱基是G,合成的时候前面加了CACCG,没有把G去掉,会有什么影响吗?
您好,这个没有关系 而且是正确的做法 没有G的时候还建议加一个
您好 请问sgRNA设计的时候第一位碱基是A不是G,然后我是把A换成G,并没有另外加上一个G,请问这个对后面的识别影响大吗?万分感谢
您好,直接替换肯定不合适,应该添加一个G,这是一段target序列,现在相当于只有19个碱基,就是可能脱靶效应可能增强;咱如果可以还是重新做一下吧
进哥,请问把两个靶点构建在同一个Cas9载体上和分别把两个靶点分别构建在Cas9载体上有什么区别吗?我不理解。并且,请问什么叫单转和混转?
你好 不好意思 给刚看见 两个构建在一个里面需要另外再克隆一个启动子和gRNA序列进去,也就是两个sgRNA独立,不能直接串联;当然加在两个载体上也可以;两种差不多 一种前期构建麻烦一点 一种后期转染条件优化麻烦一点 效果一样
老师,请教一下,sgRNA启动子是U6,它是从G开始转录,所以转录出来的是和target配对的20个碱基,现在我把U6换成了其他的启动子,那么那么转录出来的gRNA 5’端就会多出来10个碱基,这个gRNA结合CAS9以后会自动修饰掉多出来的这10个碱基吗,如果没删除掉,这个gRNA还会识别靶基因吗
您好,应该是没有问题得,不会被cas9修饰掉
顺便问一下为什么会多出十个碱基?启动子后面有冗余序列?可以通过去掉这些碱基
老师,文章里有时会看到单链的sgRNA,这个和平时所用的双链sgRNA有啥区别呢?各有啥优劣势呐?期待您的回复 谢谢您
sgRNA设计出来是单条,要自己设计上互补的另一条链,退火形成双链DNA才能与质粒连接。这个教程里面说过了。
老师,选择的CRISPR-Cas骨架载体中U6 promoter 和sgRNA scaffold中间距离较近,(例如:载体pSpCas9(BB)-2A-Puro (PX459) V2.0),中间没有酶切位点怎么处理呢?sgRNA 可以连接在sgRNA scaffold下游吗?期待您的回复,谢谢老师。
您好,当然不能在scaffold下游,我查了这个质粒说明书,https://media.addgene.org/data/plasmids/62/62988/62988-attachment_KsK1asO9w4owD8K6wp8.pdf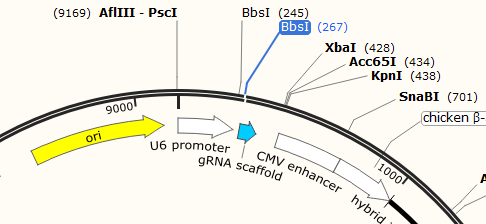
酶切位点为:Bbsi,位于U6和scaffold之间,因为不是常见酶,一般不会默认标出来,你查看一下序列即可,建议使用snapgene软件
你好,想问一下利用CRISPR cas 技术切割后,接下来怎么构建HMEJ同源重组载体,求老师指点,感恩!
你是要构建敲入质粒吗?还是只是敲除,敲入的话需要donor质粒 可以加微信详聊
你好,请问连接的是四敲载体,T0代检测其中一个靶点未被编辑,后面三个靶点有被编辑的可能吗?
你好,不清楚你具体怎么构建的,拼装到一个载体上的话 四敲有各自的guide RNA和转录原件的话互不影响;单独四个载体的话也不会相互影响。多位点敲除我没有具体实施过,希望有机会可以继续探讨
感谢回答,我还有一个问题,靶点靠近终止子,而且这个靶点成功靶向,那么这个基因靶序列前面是照常翻译的,只在靠近终止子附近提前终止,这个结果算是被成功编辑吗?与靠近启动子的靶序列在结果上会有偏差吗?希望得到你的回复,谢谢
如果编辑成功,也是在终止子附近发生碱基随机缺失,这就有很多种可能性,缺失3的倍数的碱基就少相应的氨基酸,还是到原来的终止子位置停止;如果不是,就是移码突变,有可能提前终止 也有可能延后。
如你所说,终止子附近的突变可能对蛋白功能影响比较小,甚至没有影响,与你蛋白功能结构域相关。
如果启动子,一旦移码突变,蛋白完全改变。
so,你理解一下,尽量往上游设计
我的shRNA载体也是没有信号 是什么原因 求老师指点
加我微信讨论吧 18021308280
你好! 前辈,我想问一下,构建敲除载体,转化DH5a,菌P的条带很亮,但是送测得时候,没信号是什么原因呢? 我应该怎样调整一下呢?
你好,要不你加我微信讨论吧 18021308280 说不清
你好,请问下最近在做一个基因的CRISPR,目标基因长度在7k左右,有两个cds区,分别位于基因的前端与尾端附近,且这两个cds分别位于两个可变剪切上,但不清楚基因的功能到底是哪个cds发挥作用、共同作用或者都具有作用(有其他文献报道cds2突变会导致功能改变,但两个蛋白序列具有一定的差异)。在进行双靶或多靶crispr载体构建时(promoter-sgRNA1-promoter-sgRNA2-promoter-Cas9),若靶点只作用在cds1区域,会不会使cds2进行突变呢?
你好,你是在疑问设计了靶向其中一个CDS的gRNA,会不会影响另外一个吗?你设计的位点是基因的promotor区?如果这样的话,势必两个都会有影响,敲除影响的是整个基因的转录。
如果你是要分别研究两个CDS,可以分别在两个CDS靠近5‘端的位置设计gRNA。
另外您做双靶点切除是如何做?promoter-sgRNA1-promoter-sgRNA2-promoter-Cas9,我不太明白,我所知道的是如果连个sgRNA不在一个质粒上,那就是同时转染两个质粒,如果要在一个载体上,需要两个sgRNA分别有各自的promotor和cas9。
当然可能是我知识有限,还望可以一起讨论
您好,请问 如果设计的GRNA oligo是原目的基因的reverse端,那还是在forward端加CACC吗,还是应该以oligo 5‘端加cacc,互补链加 AAAC?拜托了
您好,sgRNA敲除载体构建时两端添加的是BsmBI酶切后的同源序列,目的是将oligo插入酶切后载体,与其位置无关。不管oligo target的位置是在正义链或反义链,都是一样在oligo的5’端添加
明白啦,感恩解惑!
您好,最近在准备做CRISPR,想问一下前辈,连接之后做转化是必须用Stbl3感受态吗?可以用DH5α或者是TOP10吗?
您好 当然不啦,做扩增型的质粒都可以,我现在用的就是TOP10